13.1
Cho phương trình nhiệt hóa học của phản ứng:
2H2(g) + O2(g) -> 2H2O(1) \({\Delta _r}H_{298}^0 = - 571,68kJ\)
Phản ứng trên là phản ứng
A. thu nhiệt.
B. toả nhiệt.
C. không có sự thay đổi năng lượng.
D. có sự hấp thụ nhiệt lượng từ môi trường xung quanh.

- \({\Delta _r}H_{298}^0\) Phản ứng tỏa nhiệt
- \({\Delta _r}H_{298}^0\) > 0 => Phản ứng thu nhiệt

- Vì \({\Delta _r}H_{298}^0\) Phản ứng tỏa nhiệt
=> Đáp án: B
13.2
Cho phương trình nhiệt hóa học của phản ứng:
N2(g) + O2(g) -> 2NO(g) \({\Delta _r}H_{298}^0 = + 179,20kJ\)
Phản ứng trên là phản ứng
A. thu nhiệt.
B. không có sự thay đổi năng lượng.
C. toả nhiệt.
D. có sự giải phóng nhiệt lượng ra môi trường.

- \({\Delta _r}H_{298}^0\) Phản ứng tỏa nhiệt
- \({\Delta _r}H_{298}^0\) > 0 -> Phản ứng thu nhiệt

- Vì \({\Delta _r}H_{298}^0\) > 0 -> Phản ứng thu nhiệt
=> Đáp án: A
13.3
Dựa vào phương trình nhiệt hoá học của phản ứng sau:
CO2(g) -> CO(g) + \(\frac{1}{2}\)O2(g) \({\Delta _r}H_{298}^0 = + 280kJ\)
Giá trị \({\Delta _r}H_{298}^0\) của phản ứng: 2CO2(g) ” 2CO(g) + O2(g) là:
A. +140 kJ.
B. -1120 kJ.
C. +560 kJ.
D. -420 kJ.

Dựa vào 2 phương trình gấp nhau bao nhiêu lần thì \({\Delta _r}H_{298}^0\) cũng gấp nhau bấy nhiêu lần

- Phương trình: CO2(g) => CO(g) + \(\frac{1}{2}\)O2(g) có \({\Delta _r}H_{298}^0 = + 280kJ\)
=> 2CO2(g) -> 2CO(g) + O2(g) có \({\Delta _r}H_{298}^0 = 2.( + 280) = 560kJ\)
=> Đáp án: C
13.4
Phương trình nhiệt hóa học:
3H2(g) + N2(g) -> 2NH3(g) \({\Delta _r}H_{298}^0 = - 91,80kJ\)
Lương nhiệt toả ra khi dùng 9 g H2(g) để tạo thành NH3(g) là
A. -275,40 kJ.
B. -137,70 kJ.
C.-45,90 kJ.
D. -183,60 kJ.

- Tính số mol H2 => Tỉ lệ giữa số mol H2 ban đầu và số mol H2 đề cho => \({\Delta _r}H_{298}^0\) theo số mol H2 đề cho

- \({n_{{H_2}}} = \frac{9}{2} = 4,5\)mol => Tỉ lệ giữa \({n_{{H_2}}}\)ban đầu và \({n_{{H_2}}}\)đề cho = \(\frac{3}{{4,5}} = \frac{2}{3}\)
=> \({\Delta _r}H_{298}^0 = - 91,80.\frac{3}{2} = - 137,70kJ\)
=> Đáp án: B
13.5
Điều kiện nào sau đây không phải là điều kiện chuẩn?
A. Áp suất 1 bar và nhiệt độ 25°C hay 298 K.
B. Áp suất 1 bar và nhiệt độ 298 K
C. Áp suất 1 bar và nhiệt độ 25°C.
D. Áp suất 1 bar và nhiệt độ 25 K

Dựa vào điều kiện chuẩn: áp suất 1 bar và nhiệt độ 25°C hay 298 K

- Đáp án: D
13.6
Dựa vào phương trình nhiệt hoá học của các phản ứng sau
CS2(l) + 3O2(g) -> CO2(g) + 2SO2(g) \({\Delta _r}H_{298}^0 = - 1110,21kJ\) (1)
CO2(g) -> CO(g) + \(\frac{1}{2}\)O2(g) \({\Delta _r}H_{298}^0 = + 280,00kJ\) (2)
Na(s) + 2H2O(l) -> NaOH(aq) + H2(g) \({\Delta _r}H_{298}^0 = - 367,50kJ\) (3)
ZnSO4(s) -> ZnO(s) + SO3(g) \({\Delta _r}H_{298}^0 = + 235,21kJ\) (4)
Cặp phản ứng thu nhiệt là
A. (1) và (2).
B (3) và (4).
C. (1) và (3).
D. (2) và (4).

- \({\Delta _r}H_{298}^0\) Phản ứng tỏa nhiệt
- \({\Delta _r}H_{298}^0\) > 0 -> Phản ứng thu nhiệt

- Phản ứng (2) và (4) có \({\Delta _r}H_{298}^0\) > 0 -> Phản ứng thu nhiệt
- Đáp án: D
13.7
Dựa vào phương trình nhiệt hoá học của phản ứng sau:
3Fe(s) + 4H2O(l) -> Fe3O4(s) + 4H2(g) \({\Delta _r}H_{298}^0 = + 26,32kJ\)
Giá trị \({\Delta _r}H_{298}^0\) của phản ứng: Fe3O4(s) + 4H2(g) -> 3Fe(s) + 4H2O(l) là
A. -26,32 kJ.
B. +13,16 kJ.
C. +19,74 kJ.
D. -10,28 kJ.

Dựa vào: khi đảo chiều phản ứng thì giá trị \({\Delta _r}H_{298}^0\) cũng sẽ bị đảo ngược

- Đáp án: A
13.8
a) Enthalpy tạo thành của hợp chất là gì?
b) Biến thiên enthalpy trong các phản ứng hoá học là gì?
c) Enthalpy tạo thành khác với enthalpy tạo thành chuẩn ở điểm nào?
d) Tại sao enthalpy tạo thành chuẩn của đơn chất lại bằng không?

a) Enthalpy tạo thành (hay nhiệt tạo thành) của một chất là nhiệt kèm theo phản ứng tạo thành 1 mol chất đó từ các đơn chất bền nhất
b) Biến thiên enthalpy trong phản ứng hóa học là lượng nhiệt tỏa ra hay thu vào của một phản ứng hóa học trong quá trình đẳng áp (áp suất không đổi)
c) Enthalpy tạo thành khác với enthalpy tạo thành chuẩn ở chỗ: enthalpy tạo thành chuẩn được đo ở điều kiện chuẩn (áp suất 1 bar và nhiệt độ 25°C hay 298 K)
d) Enthalpy tạo thành chuẩn của đơn chất lại bằng không vì đơn chất bền nên không có sự thay đổi
13.9
Các quá trình sau đây là tỏa nhiệt hay thu nhiệt?
a) Nước hóa rắn.
b) Sự tiêu hoá thức ăn.
c) Quá trình chạy của con người.
d) Khí CH4 đốt ở trong lò.
e) Hoà tan KBr vào nước làm cho nước trở nên lạnh.
g) Sulfuric acid đặc khi thêm vào nước làm cho nước nóng lên.

- Thông thường
+ Các quá trình tạo thành các liên kết mới là quá trình tỏa nhiệt
+ Các quá trình phá hủy các liên kết là quá trình thu nhiệt
- Nếu sau phản ứng:
+ Môi trường tăng nhiệt độ => quá trình tỏa nhiệt
+ Môi trường giảm nhiệt độ => quá trình thu nhiệt

a) Nước hóa rắn. => Hình thành các liên kết mới giữa các phân tử nước => Quá trình tỏa nhiệt
b) Sự tiêu hoá thức ăn. => Phá hủy các liên kết trong thức ăn => Quá trình thu nhiệt
c) Quá trình chạy của con người. => Hình thành các liên kết mới giữa các phân tử để cung cấp thêm năng lượng hoặc sinh ra mồ hôi, cơ thể nóng lên => Quá trình tỏa nhiệt
d) Khí CH4 đốt ở trong lò. => Phá hủy các liên kết trong phân tử CH4 => Quá trình tỏa nhiệt
Advertisements (Quảng cáo)
e) Hoà tan KBr vào nước làm cho nước trở nên lạnh. => KBr hấp thụ nhiệt từ nước => Quá trình thu nhiệt
g) Sulfuric acid đặc khi thêm vào nước làm cho nước nóng lên. => H2SO4 tỏa nhiệt vào nước => Quá trình tỏa nhiệt
13.10
Hãy nêu 1 phản ứng toả nhiệt và 1 phản ứng thu nhiệt mà em biết.

- \({\Delta _r}H_{298}^0\) Phản ứng tỏa nhiệt
- \({\Delta _r}H_{298}^0\) > 0 => Phản ứng thu nhiệt

- Phản ứng tỏa nhiệt: CuSO4(aq) + Zn(s) -> ZnSO4(aq) + Cu(s)
có \({\Delta _r}H_{298}^0\) = -231,04kJ < 0
- Phản ứng thu nhiệt: C(s) + H2O(aq) -> CO(g) + H2(g)
có \({\Delta _r}H_{298}^0\) = +131,25kJ > 0
13.11
Khi đun nóng muối ammonium nitrate bị nhiệt phân theo phương trình:
NH4NO3 -> N2O + 2H2O
Hãy dự đoán phản ứng trên là toả nhiệt hay thu nhiệt.

- Thông thường
+ Các quá trình tạo thành các liên kết mới là quá trình tỏa nhiệt
+ Các quá trình phá hủy các liên kết là quá trình thu nhiệt

- Phản ứng trên là phản ứng thu nhiệt vì phải cung cấp thêm nhiệt độ từ môi trường bên ngoài để phá hủy các liên kết trong phân tử ammonium nitrate
13.12
Một phản ứng mà giá trị của \({\Delta _r}H_{298}^0\) > 0 thì phản ứng đó không xảy ra ở điều kiện chuẩn nếu không cung cấp năng lượng. Giải thích.

Dựa vào ý nghĩa của \({\Delta _r}H_{298}^0\) > 0 => phản ứng thu nhiệt (cần cung cấp thêm nhiệt độ từ môi trường để phản ứng xảy ra)

- Phản ứng có \({\Delta _r}H_{298}^0\) > 0 thì không tự xảy ra do cần phải được cung cấp thêm nhiệt độ (năng lượng) từ bên ngoài.
- Vì vậy, nếu chỉ có các chất tham gia mà không cung cấp thêm nhiệt độ hay năng lượng thì phản ứng sẽ không tự xảy ra.
13.13
Cho các đơn chất sau đây: C(graphite, s), Br2(1), Br2(g), Na(s), Na(g), Hg(1), Hg(s). Đơn chất nào có \({\Delta _f}H_{298}^0\) = 0?

Dựa vào: các đơn chất ở trạng thái bền (trạng thái tồn tại tự nhiên) sẽ có \({\Delta _f}H_{298}^0\) = 0

- Trạng thái bền (trạng thái tồn tại tự nhiên) của các chất là C ở dạng rắn; Br2 ở dạng lỏng, Na ở dạng rắn và Hg ở dạng lỏng
- Các đơn chất C(graphite, s), Br2(l), Na(s), Hg(l) sẽ có \({\Delta _f}H_{298}^0\) = 0
13.14
Cho 2 sơ đồ biểu diễn sự thay đổi nhiệt độ theo thời gian của phản ứng (1) và (2). Sơ đồ nào chỉ quá trình thu nhiệt và sơ đồ nào chỉ quá trình toả nhiệt. Giải thích.
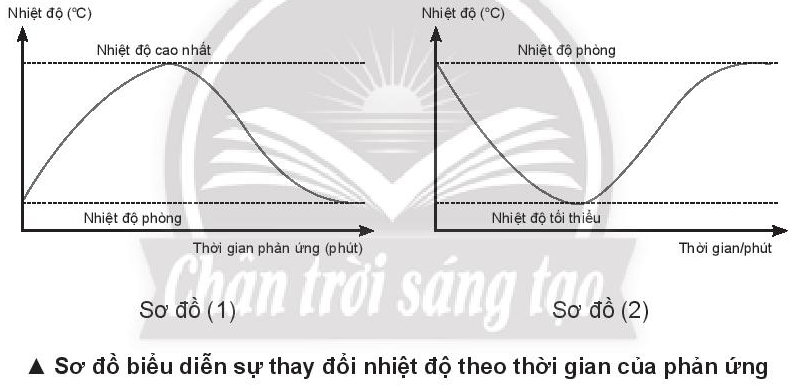

- Nếu sau phản ứng:
+ Môi trường tăng nhiệt độ => quá trình tỏa nhiệt
+ Môi trường giảm nhiệt độ => quá trình thu nhiệt

- Ở sơ đồ (1), nhiệt độ phòng tăng => quá trình tỏa nhiệt
- Ở sơ đồ (2), nhiệt độ phòng giảm => quá trình thu nhiệt
13.15
Dựa vào Bảng 13.1, SGK trang 84, viết phương trình nhiệt hoá học của 2 phản ứng sau đây:
a) Phản ứng tạo thành Al2O3.
b) Phản ứng tạo thành NO.

Dựa vào bảng 13.1 để xác định enthalpy tạo thành chuẩn của Al2O3 và NO
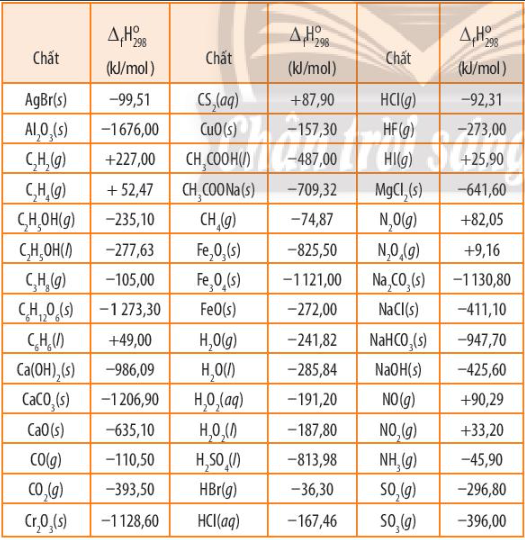

a) 4Al(s) + 3O2(g) ->2Al2O3(s) \({\Delta _r}H_{298}^0 = - 1676,00kJ\)
b) N2(g) + O2(g) -> 2NO(g) \({\Delta _r}H_{298}^0 = + 90,29kJ\)
13.16
Viết phương trình nhiệt hoá học ứng với sơ đồ biểu diễn biến thiên enthalpy của hai phản ứng sau:
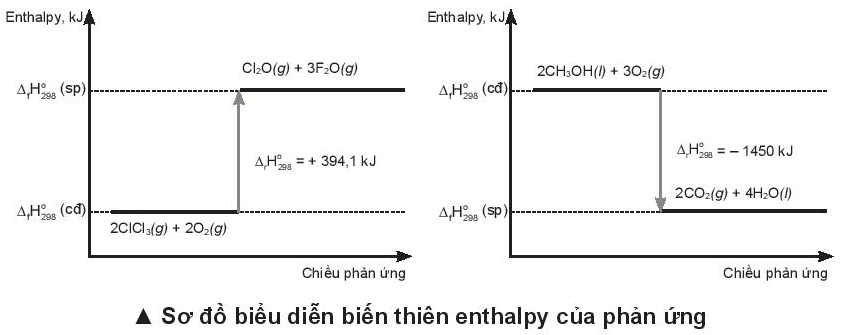

- Xác định các chất tham gia (tại \({\Delta _r}H_{298}^0(cd)\)) và các chất sản phẩm (tại \({\Delta _r}H_{298}^0(sp)\))
- Viết phương trình phản ứng và \({\Delta _r}H_{298}^0\)

a) 2ClF3(g) + 2O2(g) -> Cl2O(g) + 3F2O(g) \({\Delta _r}H_{298}^0 = + 394,1kJ\)
b) 2CH3OH(l) + 3O2(g) -> 2CO2(g) + 4H2O(l) \({\Delta _r}H_{298}^0 = - 1450kJ\)
13.17
Cho phản ứng:
2ZnS(s) + 3O2(g) -> 2ZnO(s) + 2SO2(g) \({\Delta _r}H_{298}^0 = - 285,66kJ\)
Xác định giá trị của \({\Delta _r}H_{298}^0\) khi
a) Lấy gấp 3 lần khối lượng của các chất phản ứng.
b) Lấy một nửa khối lượng của các chất phản ứng.
c) Đảo chiều của phản ứng.

- Chất tham gia gấp bao nhiêu lần về khối lượng/ số mol -> \({\Delta _r}H_{298}^0\) gấp bấy nhiêu lần
- Khi đảo chiều phản ứng -> \({\Delta _r}H_{298}^0\) có giá trị ngược lại

a) Lấy gấp 3 lần khối lượng của các chất phản ứng.
=> \({\Delta _r}H_{298}^0\) = -285,66.3 = -856,98 kJ
b) Lấy một nửa khối lượng của các chất phản ứng.
=> \({\Delta _r}H_{298}^0\) = -285,66:2 = -142,83 kJ
c) Đảo chiều của phản ứng.
=> \({\Delta _r}H_{298}^0\) = +285,66 kJ
13.18
Điều chế NH3 từ N2(g) và H2(g) làm nguồn chất tải nhiệt, nguồn đề điều chế nitric acid và sản xuất phân urea.
Viết phương trình nhiệt hoá học của phản ứng tạo thành NH3 biết khi sử dụng 7 g khí N2 sinh ra 22,95 kJ nhiệt

- Tính số mol N2 => Chuyển về phản ứng có 1 mol N2 => Tính \({\Delta _r}H_{298}^0\) theo phản ứng có 1 mol N2
- Các dấu hiệu nhận biết dấu của \({\Delta _r}H_{298}^0\)
+ Sinh ra, tỏa ra,… => \({\Delta _r}H_{298}^0\) mang giá trị âm
+ Thu vào, cần cung cấp,… => \({\Delta _r}H_{298}^0\) mang giá trị dương

- \({n_{{N_2}}} = \frac{7}{{28}} = 0,25\) mol có \({\Delta _r}H_{298}^0 = - 22,95kJ\)
=> 1 mol N2 có \({\Delta _r}H_{298}^0 = - 22,95.4 = - 91,8kJ\)
- Có phương trình nhiệt hóa học:
\({\Delta _r}H_{298}^0 = - 91,8kJ\)
13.19
Viết phương trình nhiệt hoá học của các quá trình tạo thành những chất dưới đây từ đơn chất.
a) Nước ở trạng thái khí, biết rằng khi tạo thành 1 mol hơi nước toả ra 214,6 kJ nhiệt
b) Nước lỏng, biết rằng sự tạo thành 1 mol nước lỏng toả ra 285,49 kJ nhiệt.
c) Ammonia (NH3), biết rằng sự tạo thành 2,5 g ammonia toả ra 22,99 kJ nhiệt.
d) Phản ứng nhiệt phân đá vôi (CaCO3), biết rằng để thu được 11,2 g với (CaO) phải cung cấp 6,94 kcal.

- Các dấu hiệu nhận biết dấu của \({\Delta _f}H_{298}^0\)
+ Sinh ra, tỏa ra,… => \({\Delta _f}H_{298}^0\) mang giá trị âm
+ Thu vào, cần cung cấp,… => \({\Delta _f}H_{298}^0\) mang giá trị dương

a) H2(g) + \(\frac{1}{2}\)O2(g) -> H2O(g) \({\Delta _f}H_{298}^0 = - 214,6kJ/mol\)
b) H2(g) + \(\frac{1}{2}\)O2(g) -> H2O(l) \({\Delta _f}H_{298}^0 = - 285,49kJ/mol\)
c) - \({n_{N{H_3}}} = \frac{{2,5}}{{17}} = \frac{5}{{34}}\) mol -> Phản ứng tạo ra \(\frac{5}{{34}}\) mol NH3 có \({\Delta _f}H_{298}^0 = - 22,99kJ/mol\)
=> Phản ứng tạo ra 2 mol NH3 có \({\Delta _f}H_{298}^0 = - 22,99:\frac{5}{{34}}.2 = - 312,664kJ/mol\)
=> Phương trình nhiệt hóa học:
\({\Delta _f}H_{298}^0 = - 312,664kJ/mol\)
d) - \({n_{CaO}} = \frac{{11,2}}{{56}} = 0,2\) mol => Phản ứng tạo ra 0,2 mol CaO có \({\Delta _f}H_{298}^0 = + 6,94kcal/mol\)
=> Phản ứng tạo ra 1 mol CaO có \({\Delta _f}H_{298}^0 = + 6,94.5 = + 34,7kcal/mol\)
=> Phương trình nhiệt hóa học:
\({\Delta _f}H_{298}^0 = + 34,7kcal/mol\)
13.20
Dựa vào Bảng 13.1, SGK trang 84, sắp xếp các oxide sau đây: Fe2O3(s), Cr2O3(s), Al2O3(s) theo thứ tự giảm dần độ bền nhiệt.

So sánh \({\Delta _f}H_{298}^0\) của các chất, chất nào có \({\Delta _f}H_{298}^0\) càng lớn thì càng kém bền
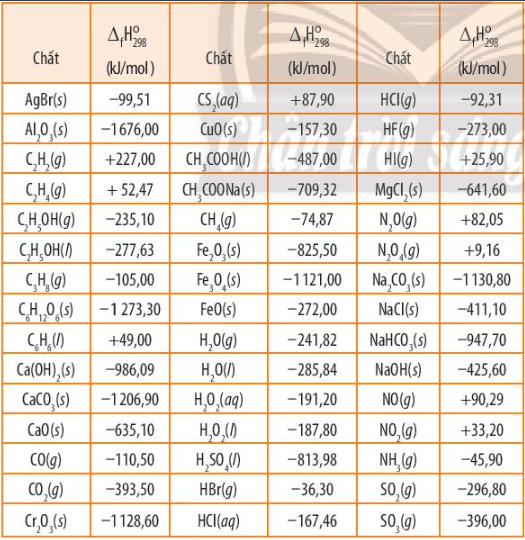

- Từ bảng số liệu ta thấy:
\({\Delta _f}H_{298}^0(F{e_2}{O_3}) = - 825,50kJ/mol\) > \({\Delta _f}H_{298}^0(C{r_2}{O_3}) = - 1128,60kJ/mol\) > \({\Delta _f}H_{298}^0(A{l_2}{O_3}) = - 1676,00kJ/mol\)
=> Thứ tự giảm dần độ bền nhiệt là: Al2O3(s), Cr2O3(s), Fe2O3(s)
