5.1
Tìm hiểu và giải thích 2 quá trình sau:
a) Tại sao khi xoa cồn vào da, ta cảm thấy lạnh?
b) Phản ứng phân huỷ Fe(OH)3(s) phải cung cấp nhiệt độ liên tục.

- Phản ứng thu nhiệt: cần cung cấp năng lượng từ bên ngoài môi trường -> giảm nhiệt độ,…
- Phản ứng tỏa nhiệt: giải phóng năng lượng ra bên ngoài môi trường -> tăng nhiệt độ,…

a) Khi xoa vào da, cồn sẽ hút bớt một lượng nhiệt trên da và do cồn có nhiệt độ bay hơi thấp nên ta sẽ cảm thấy mát ở vùng da đó
b) Phản ứng phân hủy Fe(OH)3 là phản ứng thu nhiệt nên cần phải cung cấp nhiệt độ liên tục
2Fe(OH)3(s) -> Fe2O3 + 3H2O
5.2
Cho phương trình nhiệt hoá học của phản ứng sau:
C(kim cương) → C(graphite) \({\Delta _r}H_{298}^0 = - 1,9{\rm{ }}kJ\)
Kim cương hay graphite là dạng bền hơn của carbon?

- \({\Delta _r}H_{298}^0\) Phản ứng tỏa nhiệt => Quá trình tự diễn ra xảy ra thuận lợi hơn
- \({\Delta _r}H_{298}^0\) > 0 => Phản ứng thu nhiệt => Quá trình tự diễn ra xảy ra kém thuận lợi hơn vì cần cung cấp nhiệt độ bên ngoài môi trường

- \({\Delta _r}H_{298}^0 = - 1,9{\rm{ }}kJ\) Quá trình tự diễn ra xảy ra thuận lợi hơn ” Graphite là dạng bền hơn của carbon
5.3
Cho hai phương trình nhiệt hoá học sau:
CO(g) + \(\frac{1}{2}\)O2(g) → CO2(g) \({\Delta _r}H_{298}^0 = - 283,00{\rm{ }}kJ\) (1)
H2(g) + F2(g) → 2HF(g) \({\Delta _r}H_{298}^0 = - 546,00{\rm{ }}kJ\) (2)
So sánh nhiệt giữa hai phản ứng (1) và (2). Phản ứng nào xảy ra thuận lợi hơn?

- \({\Delta _r}H_{298}^0\) Phản ứng tỏa nhiệt => Quá trình tự diễn ra xảy ra thuận lợi hơn
- \({\Delta _r}H_{298}^0\) > 0 => Phản ứng thu nhiệt => Quá trình tự diễn ra xảy ra kém thuận lợi hơn vì cần cung cấp nhiệt độ bên ngoài môi trường
- Giá trị \({\Delta _r}H_{298}^0\) càng nhỏ thì phản ứng xảy ra càng thuận lợi

- Vì \({\Delta _r}H_{298}^0 = - 546,00{\rm{ }}kJ\) (2) Phản ứng (2) xảy ra thuận lợi hơn
5.4
Cho hai phương trình nhiệt hóa học sau
CO(g) + \(\frac{1}{2}\)O2(g) → CO2(g) \({\Delta _r}H_{298}^0 = - 283,00{\rm{ }}kJ\) (1)
C2H5OH(l) + \(\frac{7}{2}\)O2 → 2CO2(g) + 3H2O(l) \({\Delta _r}H_{298}^0 = - 1366,89{\rm{ }}kJ\) (2)
Khi đốt cháy cùng 1 mol CO và C2H5OH thì phản ứng nào toả ra lượng nhiệt lớn hơn?

- \({\Delta _r}H_{298}^0\) Phản ứng tỏa nhiệt => Quá trình tự diễn ra xảy ra thuận lợi hơn
- \({\Delta _r}H_{298}^0\) > 0 => Phản ứng thu nhiệt => Quá trình tự diễn ra xảy ra kém thuận lợi hơn vì cần cung cấp nhiệt độ bên ngoài môi trường
- Giá trị \({\Delta _r}H_{298}^0\) càng nhỏ thì phản ứng xảy ra càng thuận lợi

- Vì \({\Delta _r}H_{298}^0 = - 1366,89{\rm{ }}kJ\) (2) Phản ứng (2) xảy ra thuận lợi hơn
5.5
Cho phương trình nhiệt hoá học sau:
H2(g) + F2(g) → 2HF(g) \({\Delta _r}H_{298}^0 = - 546,00{\rm{ }}kJ\)
Vẽ sơ đồ biểu diễn biến thiên enthalpy của phản ứng.

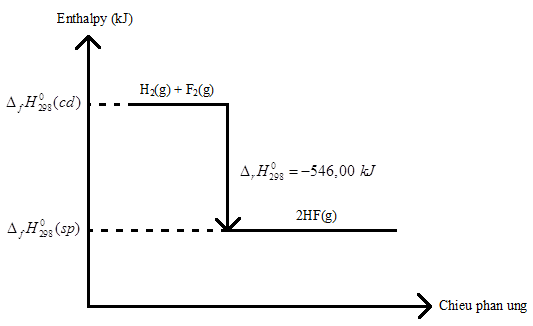
5.6
Cho các phương trình nhiệt hoá học sau:
2H2(g) + O2(g) -> 2H2O(l) \({\Delta _r}H_{298}^0 = - 571,68{\rm{ }}kJ\)
\(\frac{1}{2}\)H2(g) + \(\frac{1}{2}\)I2(g) -> HI(g) \({\Delta _r}H_{298}^0 = + 25,9{\rm{ }}kJ\)
Xác định biến thiên enthalpy của 2 phản ứng sau:
H2(g) + \(\frac{1}{2}\)O2(g) -> H2O(l)
HI(g) -> \(\frac{1}{2}\)H2(g) + \(\frac{1}{2}\)I2(g)

- Chất tham gia gấp bao nhiêu lần về khối lượng/ số mol => \({\Delta _r}H_{298}^0\) gấp bấy nhiêu lần
- Khi đảo chiều phản ứng => \({\Delta _r}H_{298}^0\) có giá trị ngược lại

- Phương trình: H2(g) + \(\frac{1}{2}\)O2(g) -> H2O(l) có \({\Delta _r}H_{298}^0 = \frac{1}{2}.( - 571,68) = - 285,84{\rm{ }}kJ\)
- Phương trình: HI(g) -> \(\frac{1}{2}\)H2(g) + \(\frac{1}{2}\)I2(g) có \({\Delta _r}H_{298}^0 = - 25,9{\rm{ }}kJ\)
5.7
Mỗi quá trình dưới đây là tự diễn ra hay không?
a) Cho CaC2 vào nước, khí C2H2 thoát ra.
b) Khí CO khử FeO ở nhiệt độ phòng.
c) Các phân tử nước được chuyển thành khí hydrogen và oxygen.
Với quá trình không tự diễn ra, dự đoán giá trị của nhiệt phản ứng.

- \({\Delta _r}H_{298}^0\) Phản ứng tỏa nhiệt => Quá trình tự diễn ra xảy ra thuận lợi hơn
- \({\Delta _r}H_{298}^0\) > 0 => Phản ứng thu nhiệt => Quá trình tự diễn ra xảy ra kém thuận lợi hơn vì cần cung cấp nhiệt độ bên ngoài môi trường

a) Quá trình tự diễn ra do phản ứng tỏa nhiệt CaC2 + 2H2O -> Ca(OH)2 + C2H2
b) Quá trình không tự diễn ra => \({\Delta _r}H_{298}^0\) > 0
c) Quá trình không tự diễn ra => \({\Delta _r}H_{298}^0\) > 0
5.8
Thí nghiệm phân huỷ hydrogen peroxide (H2O2) thành nước và khí oxygen có xúc tác KI theo phương trình nhiệt hoá học sau:
2H2O2(aq) -> O2(g) + 2H2O(l) \({\Delta _r}H_{298}^0 = - 196{\rm{ }}kJ\)
Phản ứng trên là phản ứng thu nhiệt hay toả nhiệt? Hãy đề xuất cách chứng minh khí sinh ra là oxygen. Nêu ứng dụng của thí nghiệm trên trong thực tiễn.

- \({\Delta _r}H_{298}^0\) Phản ứng tỏa nhiệt
- \({\Delta _r}H_{298}^0\) > 0 -> Phản ứng thu nhiệt
- Sử dụng tính chất vật lý hoặc hóa học của oxygen để chứng minh khí sinh ra là oxygen:
+ Làm bùng cháy tàn đóm đỏ
+ Tác dụng với Cu là chất rắn màu đỏ tạo thành chất rắn màu đen CuO

- Vì phản ứng có \({\Delta _r}H_{298}^0 = - 196{\rm{ }}kJ\) Phản ứng tỏa nhiệt
- Cho tàn đóm đỏ vào miệng ống nghiệm, tàn đóm bùng cháy chứng tỏ có O2 sinh ra
Advertisements (Quảng cáo)
- Ứng dụng của H2O2:
+ Nước oxi già có thành phần là dung dịch H2O2 với nồng độ dưới 3% có tác dụng sát trùng vết thương, loại bỏ tế bào chết
+ Khử trùng, sát khuẩn nước, xử lý nước trong hồ
5.9
Cho phương trình nhiệt hoá học sau:
NaOH(aq) + HCl(aq) → NaCl(aq) + H2O(l) \({\Delta _r}H_{298}^0 = - 57,3{\rm{ }}kJ\)
a) Vẽ sơ đồ biểu diễn biến thiên enthalpy của phản ứng.
b) Tính lượng nhiệt toả ra khi dùng dung dịch có chứa 8 g NaOH trung hoà với lượng vừa đủ dung dịch HCl.

- Tính số mol Na => Tính \({\Delta _r}H_{298}^0\) theo phản ứng có số mol Na tương ứng
+ Chất tham gia gấp bao nhiêu lần về khối lượng/ số mol => \({\Delta _r}H_{298}^0\) gấp bấy nhiêu lần
+ Khi đảo chiều phản ứng => \({\Delta _r}H_{298}^0\) có giá trị ngược lại

a) 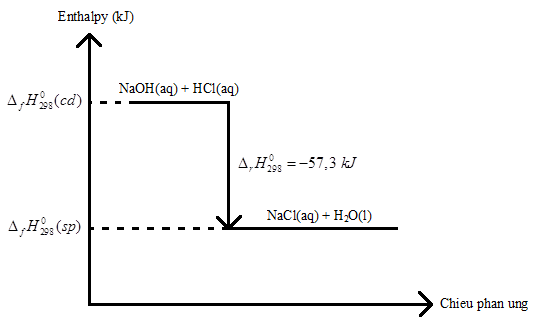
b) nNaOH = \(\frac{8}{{40}}\) = 0,2 mol ” \({\Delta _r}H_{298}^0 = 0,2.( - 57,3) = - 11,46kJ\)
5.10
Phản ứng của glycerol với nitric acid (khử nước) tạo thành trinitroglycerin (C3H5(ONO2)3). Trinitroglycerin là một loại thuốc nổ, khi phân huỷ tạo thành sản phẩm gồm có nitrogen, oxygen, carbon dioxide và hơi nước.
a) Viết phương trình phản ứng hoá học của phản ứng điều chế trinitroglycerin từ glycerol với nitric acid và phản ứng phân huỷ của trinitroglycerin.
b) Nếu phân huỷ 45,4 g trinitroglycerin, tính số mol khí và hơi tạo thành.
c) Khi phân huỷ 1 mol trinitroglycerin tạo thành 1448 kJ nhiệt lượng. Tính lượng nhiệt tạo thành khi phân huỷ 1 kg trinitroglycerin.

- Tính số mol trinitroglycerin => \({\Delta _r}H_{298}^0\) của phản ứng

a) Các phản ứng xảy ra:
C3H5(OH)3 + 3HNO3 -> C3H5(ONO2)3 + 3H2O
4C3H5(ONO2)3 ->12CO2 + 10H2O + O2 + 6N2
b) - \({n_{{C_3}{H_5}{{\left( {ON{O_2}} \right)}_3}}} = \frac{{45,4}}{{227}} = 0,2\)mol
- Ta có phương trình:
4C3H5(ONO2)3 ->12CO2 + 10H2O + O2 + 6N2
0,2 -> 0,6 0,5 0,05 0,3 (mol)
- nkhí = 0,6 + 0,05 + 0,3 = 0,95 mol
- nhơi = 0,5 mol
c) \({n_{{C_3}{H_5}{{\left( {ON{O_2}} \right)}_3}}} = \frac{{1000}}{{227}}\)mol => \({\Delta _r}H_{298}^0 = \frac{{1000}}{{227}}.( - 1448) = - 6378,85kJ\)
5.11
Cho các phương trình nhiệt hoá học của phản ứng:
a) 3H2(g) + \(\frac{3}{2}\)O2(g) → 3H2O(1) \({\Delta _r}H_{298}^0 = - 857,52{\rm{ }}kJ\)
b) 2S(s) + 3O2(g) → 2SO3(g) \({\Delta _r}H_{298}^0 = + 792,2{\rm{ }}kJ\)
Ở điều kiện chuẩn nếu đốt cháy hoàn toàn 1,2 g H2 (a) và 3,2 g S (b) thì lượng nhiệt toả ra hay cần cung cấp là bao nhiêu?

- Tính số mol H2 và S => Tính \({\Delta _r}H_{298}^0\) theo phản ứng có số mol H2 và S tương ứng
+ Chất tham gia gấp bao nhiêu lần về khối lượng/ số mol => \({\Delta _r}H_{298}^0\) gấp bấy nhiêu lần
+ Khi đảo chiều phản ứng => \({\Delta _r}H_{298}^0\) có giá trị ngược lại

a) \({n_{{H_2}}} = \frac{{1,2}}{2} = 0,6\)mol => \({\Delta _r}H_{298}^0 = 0,6.\frac{{( - 857,52)}}{3} = - {\rm{171,504}}kJ\)
b) \({n_S} = \frac{{3,2}}{{32}} = 0,1\)mol => \({\Delta _r}H_{298}^0 = 0,1.\frac{{( + 792,2)}}{2} = + 39,61kJ\)
5.12
Tìm hiểu ứng dụng của silver bromide (AgBr) trên phim ảnh. Phản ứng xảy ra là tỏa nhiệt hay thu nhiệt? Giải thích.

- \({\Delta _r}H_{298}^0\) Phản ứng tỏa nhiệt
- \({\Delta _r}H_{298}^0\) > 0 -> Phản ứng thu nhiệt

- Vì AgBr là chất nhạy cảm với ánh sáng nên dưới tác dụng của ánh sáng, AgBr sẽ bị phân hủy thành bạc ở dạng chất bột màu đen bám lên trên tấm phim và Br2 ở dạng hơi
2AgBr -> 2Ag + Br2 \({\Delta _r}H_{298}^0\) > 0
=> Phản ứng thu nhiệt
- Sau khi chụp ảnh, phim được rửa bằng dung dịch Na2S2O3 để hòa tan phần AgBr còn lại
AgBr + 2Na2S2O3 -> Na3(Ag(S2O3)2) + NaBr
5.13
Glucose là một loại monosaccarit với công thức phân tử C6H12O6 được tạo ra bởi thực vật và hầu hết các loại tảo trong quá trình quang hợp từ nước và CO2, sử dụng năng lượng từ ánh sáng mặt trời. Dung dịch glucose 5% (D = 1,1 g/mL) là dung dịch đường tiêm tĩnh mạch, là loại thuốc thiết yếu, quan trọng của Tổ chức Y tế Thế giới (WHO) và hệ thống y tế cơ bản. Phương trình nhiệt hoả học của phản ứng oxi hoá glucose:
C6H12O6(s) + 6O2(g) → 6CO2(g) + 6H2O(1) \({\Delta _r}H_{298}^0 = \; - 2{\rm{ }}803,0{\rm{ }}kJ\)
Tính năng lượng tối đa khi một người bệnh được truyền 1 chai 500 mL dung dịch glucose 5%.

Tính số mol glucose -> Tính \({\Delta _r}H_{298}^0\) theo phản ứng có số mol glucose tương ứng

Có \({m_{{C_6}{H_{12}}{O_6}}} = 1,1.500.5\% = 27,5\)gam
-> \({n_{{C_6}{H_{12}}{O_6}}} = \frac{{27,5}}{{180}} = \frac{{11}}{{72}}\)mol -> \({\Delta _r}H_{298}^0 = \;\frac{{11}}{{72}}.( - 2{\rm{ }}803,0) = - 428,236{\rm{ }}kJ\)
=> Vậy năng lượng tối đa khi một người bệnh được truyền 1 chai 500 mL dung dịch glucose 5% là 428,236 kJ
5.14
Khí gas chứa chủ yếu các thành phần chính: Propane (C3H8), butane (C4H10) và một số thành phần khác. Để tạo mùi cho gas nhà sản xuất đã pha trộn thêm chất tạo mùi đặc trưng như methanethiol (CH3SH), có mùi giống tỏi, hành tây. Trong thành khí gas, tỉ lệ hoà trộn phổ biến của propane : butane theo thứ tự là 30 : 70 đến 50 : 50.
a) Mục đích việc pha trộn thêm chất tạo mùi đặc trưng vào khí gas là gi?
b) Cho các phương trình nhiệt hoá học sau:
C3H8(s) + 5O2(g) → 3CO2(g) + 4H2O(1) \({\Delta _r}H_{298}^0 = \; - 2220{\rm{ }}kJ\)
C4H10(s) + \(\frac{{13}}{2}\)O2(g) → 4CO2(g) + 5H2O(2) \({\Delta _r}H_{298}^0 = - 2874{\rm{ }}kJ\)
Tính nhiệt lượng toả ra khi đốt cháy hoàn toàn 1 bình gas 12 kg với tỉ lệ thể tích của propane : butane là 30 : 70 (thành phần khác không đáng kể) ở điều kiện chuẩn.
c) Giả sử một hộ gia đình cần 6000 kJ nhiệt mỗi ngày, sau bao nhiêu ngày sẽ sử dụng hết 1 bình gas (với hiệu suất hấp thụ nhiệt khoảng 60%)?

- Tính số mol của propane và butane trong 12 kg bình gas => Tính \({\Delta _r}H_{298}^0\) theo phản ứng có số mol propane và butane tương ứng

a) Mục đích của việc pha trộn thêm chất tạo mùi là để giúp phát hiện ra sự cố rò rỉ khí gas nếu có
b) - Có \({m_{{C_3}{H_8}}} = 12.30\% .1000 = 3600\)gam
-> \({n_{{C_3}{H_8}}} = \frac{{3600}}{{44}} = \frac{{900}}{{11}}\)mol -> \({\Delta _r}H_{298}^0 = \;\frac{{900}}{{11}}.( - 2220) = - 181636,36{\rm{ }}kJ\)
- Có \({m_{{C_4}{H_{10}}}} = 12.70\% .1000 = 8400\)gam
=> \({n_{{C_4}{H_{10}}}} = \frac{{8400}}{{58}} = \frac{{4200}}{{29}}\)mol => \({\Delta _r}H_{298}^0 = \;\frac{{4200}}{{29}}.( - 2874) = - 416234,48{\rm{ }}kJ\)
=> Tổng năng lượng thu được khi đốt hoàn toàn 1 bình gas 12 kg đó là:
181636,36 + 416234,48 = 597870,84 (kJ)
c) Số ngày hộ gia đình đó sử dụng hết 1 bình gas 12kg kể trên là:
\(\frac{{597870,84}}{{6000}}.60\% = 59,79\) ngày
