5.1
X là nguyên tố rất cần thiết cho sự chuyển hóa của calcium, phosphorus, sodium, potassium, vitamin C và các vitamin nhóm B. Ở trạng thái cơ bản, cấu hình electron lớp ngoài cùng của nguyên tử X là 3s2. Số hiệu nguyên tử của nguyên tố X là
A. 12.
B. 13.
C. 11.
D. 14.

Khi có cấu hình electron lớp ngoài cùng của nguyên tử
- TH1: các lớp trước đó đã được lấp đầy electron
- TH2: trước lớp ngoài cùng vẫn có lớp chưa được lấp đầy electron (do có phân lớp d hoặc phân lớp f). Áp dụng với nguyên tử có cấu hình electron lớp ngoài cùng từ 4s trở lên

- Vì cấu hình electron lớp ngoài cùng của nguyên tử X là 3s2
=> Cấu hình electron của nguyên tử X là: 1s22s22p63s2
=> Số hiệu nguyên tử = số proton = số electron = 12
=> Đáp án: A
5.2
Chu kì là
A. dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron, được xếp theo chiều khối lượng nguyên tử tăng dần.
B. dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron, được xếp theo chiều số khối tăng dần.
C. dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron, được xếp theo chiều điện tích hạt nhân nguyên tử tăng dần.
D. dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron, được xếp theo chiều số neutron tăng dần.

Dựa vào
- Định nghĩa chu kì: Chu kì là dãy các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành 1 hàng
- Đặc điểm của các nguyên tố trong bảng tuần hoàn: các nguyên tố được sắp xếp theo thứ tự tăng dần số hiệu nguyên tử hay chiều tăng dần điện tích hạt nhân

=> Đáp án: C
5.3
Nhóm nguyên tố là
A tập hợp các nguyên tố mà nguyên tử có cấu hình electron giống nhau, được xếp ở cùng một cột.
B. tập hợp các nguyên tố mà nguyên tử có cấu hình electron gần giống nhau, do đó có tính chất hóa học giống nhau và được xếp thành một cột.
C. tập hợp các nguyên tố mà nguyên tử có cấu hình electron tương tự nhau, do đó có tính chất hóa học gần giống nhau và được xếp thành một cột.
D. tập hợp các nguyên tố mà nguyên tử có tính chất hóa học giống nhau và được xếp cùng một cột.

Dựa vào định nghĩa của nhóm: Nhóm là tập hợp các nguyên tố mà nguyên tử có cấu hình electron tương tự nhau, do đó có tính chất hóa học gần giống nhau và được xếp thành một cột

- Đáp án: C
5.4
Trong bảng tuần hoàn, các nguyên tố được sắp xếp không theo nguyên tắc nào?
A. Theo chiều tăng của điện tích hạt nhân.
B. Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành một hàng.
C. Các nguyên tố có cùng số electron hoá trị trong nguyên tử được xếp thành một cột.
D. Theo chiều tăng khối lượng nguyên tử.

Dựa vào nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn:
- Các nguyên tố được sắp xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử
- Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp cùng một chu kì (cùng một hàng)
- Các nguyên tố mà nguyên tử có cấu hình electron tương tự nhau được xếp thành cùng một nhóm (cùng một cột)

- Đáp án: D
5.5
Sulfur dạng kem bôi được sử dụng để điều trị mụn trứng cá. Nguyên tử sulfur có phân lớp electron ngoài cùng là 3p4. Phát biểu nào sau đây là sai khi nói về nguyên tử sulfur
A. Lớp ngoài cùng của sulfur có 6 electron.
B. Hạt nhân nguyên tử sulfur có 16 electron.
C. Trong bảng tuần hoàn sulfur nằm ở chu kì 3.
D. Sulfur nằm ở nhóm VIA.

Dựa vào
- Khi có cấu hình electron lớp ngoài cùng của nguyên tử
+ TH1: các lớp trước đó đã được lấp đầy electron
+ TH2: trước lớp ngoài cùng vẫn có lớp chưa được lấp đầy electron (do có phân lớp d hoặc phân lớp f). Áp dụng với nguyên tử có cấu hình electron lớp ngoài cùng từ 4s trở lên
- Từ cấu hình electron của nguyên tử ” các dữ kiện cần thiết
+ Số lớp electron = số chu kì
+ Số electron lớp ngoài cùng = số nhóm
+ Ô số thứ tự = điện tích hạt nhân = số proton = số electron
- Proton mang điện tích dương nằm trong hạt nhân, electron mang điện tích âm nằm ở vỏ nguyên tử

- Vì cấu hình electron lớp ngoài cùng của nguyên tử S là 3p4
=> Cấu hình electron của nguyên tử X là: 1s22s22p63s23p4
=> Lớp ngoài cùng có chứa 2 + 4 = 6 electron ” Nguyên tử S nằm ở nhóm VIA
=> Trong hạt nhân nguyên tử sulfur có 16 proton
=> Nguyên tử Sulfur có 3 lớp electron ” Sulfur nằm ở chu kì 3
=> Đáp án: B. Sai ở “electron” sửa thành “proton”
5.6
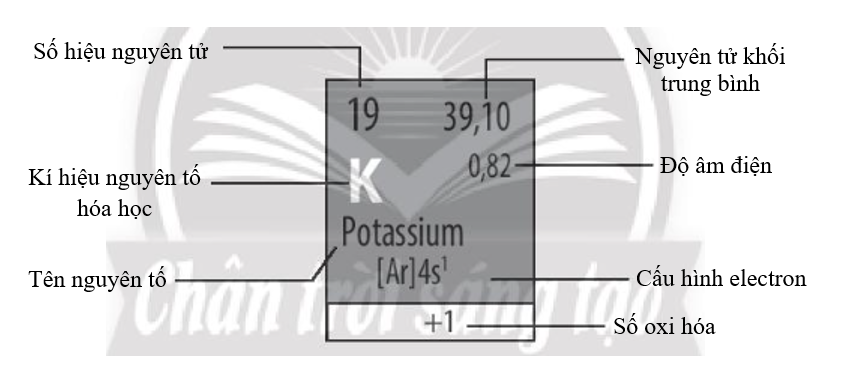
Hãy cho biết ý nghĩa của các thông tin có trong ô nguyên tố sau:
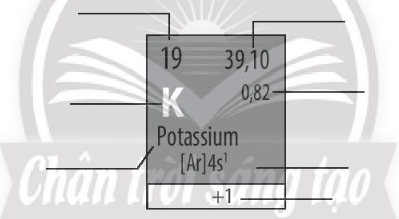

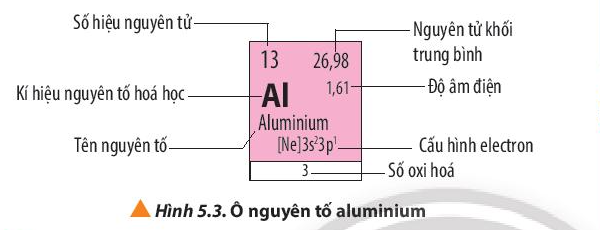
Dựa vào ý nghĩa của các thông tin trong ô nguyên tố ở Hình 5.3. Ô nguyên tố aluminium “trang 38 SGK Hóa học 10 - ”

5.7
Sử dụng bảng tuần hoàn các nguyên tố hóa học trong SGK (Hình 5.2 trang 37), hoàn thành những thông tin còn thiếu trong bảng sau:
|
Hợp chất |
Khối lượng Fe (g) |
Khối lượng O (g) |
Tỉ lệ khối lượng O : Fe |
|
FeO |
|
|
|
|
Fe2O3 |
|
|
|
|
Fe3O4 |
|
|
|

- Bước 1: Coi mỗi hợp chất có 1 mol => Số khối = khối lượng
- Bước 2: Khối lượng mỗi nguyên tố = khối lượng x chỉ số của nguyên tố đó
- Bước 3: Tính tỉ lệ khối lượng

- Coi mỗi hợp chất có 1 mol => ta có bảng sau:
|
Hợp chất |
Khối lượng Fe (g) |
Khối lượng O (g) |
Tỉ lệ khối lượng O : Fe |
|
FeO |
55,85 |
15,999 |
\(\frac{{15,999}}{{55,85}} \approx 0,286\) |
|
Fe2O3 |
55,85.2 = 111,7 |
15,999.3 = 47,997 |
\(\frac{{47,997}}{{111,7}} \approx 0,43\) |
|
Fe3O4 |
55,85.3 = 167,55 |
15,999.4 = 63,996 |
\(\frac{{63,996}}{{167,55}} \approx 0,382\) |
5.8
Hãy giải thích vì sao chu kì 3 chỉ có 8 nguyên tố.

Dựa vào
- Định nghĩa chu kì: Chu kì là dãy các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành 1 hàng
- Số phân lớp trong một lớp electron:
+ 4 lớp đầu (1, 2, 3, 4) có số phân lớp trong mỗi lớp bằng số thứ tự của lớp đó
+ 3 lớp sau (5, 6, 7) đều có 4 phân lớp
- Số electron tối đa trong mỗi phân lớp electron:
|
Phân lớp |
s |
p |
d |
f |
|
Số electron tối đa |
2 |
6 |
10 |
14 |

- Chu kì 3 có 2 phân lớp là 3s và 3p. Phân lớp 3s có tối đa 2 electron, phân lớp 3p có tối đa 6 electron => Chu kì 3 có tổng cộng tối đa 2 + 6 = 8 electron
- Mà theo định nghĩa, chu kì là dãy các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành 1 hàng
=> Chu kì 3 chỉ có thể có tối đa 8 nguyên tố hóa học
5.9
Xác định vị trí của nguyên tố (ô, chu kì và nhóm) của nguyên tố có
a) số hiệu nguyên tử là 20, là nguyên tố giúp xương chắc khoẻ, phòng ngừa những bệnh loãng xương, giảm tinh trạng đau nhức và khó khăn trong vận động, làm nhanh lành các vết nứt gãy trên xương.
b) 9 electron, được sử dụng để điều chế một số dẫn xuất hydrocarbon, làm sản phẩm trung gian để sản xuất ra chất dẻo.
c) 28 proton, được dùng trong việc chế tạo hợp kim chống ăn mòn.
d) số khối là 52 và 28 neutron, dùng chế tạo thép không gì.

Dựa vào
- Xác định số electron của nguyên tử
+ Số khối A = p + n
+ Số hiệu nguyên tử = số proton = số electron
- Các bước viết cấu hình electron của nguyên tử
+ Bước 1: Xác định số electron của nguyên tử
+ Bước 2: Các electron được phân bố theo thứ tự các AO có mức năng lượng tăng dần, theo các nguyên lý và quy tắc phân bố electron trong phân tử
+ Bước 3: Viết cấu hình electron theo thứ tự các phân lớp trong một lớp và theo thứ tự của các lớp electron
- Từ cấu hình electron của nguyên tử => các dữ kiện cần thiết
+ Số lớp electron = số chu kì
+ Số electron lớp ngoài cùng = số nhóm (đối với các nguyên tố nhóm A)
+ Ô số thứ tự = điện tích hạt nhân = số proton = số electron
- Cách xác định nhóm của các nguyên tố nhóm B có cấu hình electron lớp ngoài cùng là (n-1)dxnsy
+ TH1: 3 ≤ (x+y) ≤ 7 => Nguyên tố thuộc nhóm (x+y)B
+ TH2: 8 ≤ (x+y) ≤ 10 => Nguyên tố thuộc nhóm VIIIB
+ TH3: 11 ≤ (x+y) ≤ 12 => Nguyên tố thuộc nhóm (x+y-10)B

a) - Số hiệu nguyên tử = số electron = 20
=> Phân mức năng lượng electron: 1s22s22p63s23p64s2
=> Cấu hình electron của nguyên tử là 1s22s22p63s23p64s2
=> Đây là nguyên tố Calcium (Ca) thuộc chu kì 4, nhóm IIA, ô 20 trong bảng tuần hoàn
b) - Số electron = 9
=> Phân mức năng lượng electron: 1s22s22p5
=> Cấu hình electron của nguyên tử là 1s22s22p5
=> Đây là nguyên tố Fluorine (F) thuộc chu kì 2, nhóm VIIA, ô 9 trong bảng tuần hoàn
c) - Số proton = số electron = 28
=> Phân mức năng lượng electron: 1s22s22p63s23p64s23d8
=> Cấu hình electron của nguyên tử là 1s22s22p63s23p63d84s2
=> Đây là nguyên tố Nickel (Ni) thuộc chu kì 4, nhóm VIIIB, ô 28 trong bảng tuần hoàn
d) - Số khối A = p + n => Số proton = A - n = 52 - 28 = 24 = số electron
=> Phân mức năng lượng electron: 1s22s22p63s23p64s13d5
Advertisements (Quảng cáo)
=> Cấu hình electron của nguyên tử là 1s22s22p63s23p63d54s1
=> Đây là nguyên tố Chromium (Cr) thuộc chu kì 4, nhóm VIA, ô 24 trong bảng tuần hoàn
5.10
Viết cấu hình electron nguyên tử của các nguyên tố và xác định tên nguyên tố:
a) Chu kì 3, nhóm IIIA, được dùng trong ngành công nghiệp chế tạo, cụ thể là tạo ra các chi tiết cho xe ô tô, xe tải, tàu hoả, tàu biển và cả máy bay.
b) Chu kì 4, nhóm IB, được sử dụng rất nhiều trong sản xuất các nguyên liệu như dây điện, que hàn, tay cầm, các đồ dùng nội thất trong nhà, các tượng đúc, nam châm điện từ, các động cơ máy móc,…

Dựa vào
- Từ cấu hình electron của nguyên tử => các dữ kiện cần thiết
- Cách xác định nhóm của các nguyên tố nhóm B có cấu hình electron lớp ngoài cùng là (n-1)dxnsy
- Khi có cấu hình electron lớp ngoài cùng của nguyên tử

a) - Nguyên tử nguyên tố này thuộc chu kì 3, nhóm IIIA => Đây là nguyên tố Aluminium (Al)
=> Cấu hình electron lớp ngoài cùng là 3s23p1
=> Cấu hình electron của nguyên tố này là 1s22s22p63s23p1
b) - Nguyên tử nguyên tố này thuộc chu kì 4
-> Nguyên tố có 4 lớp electron
Nhóm IB -> có 1 electron hóa trị và nguyên tố d hoặc f
mà ta có : electron hóa trị = số electron lớp ngoài cùng + số electron ở phân lớp d chưa bão hòa
-> để e hóa trị bằng 1 thì số electron ở phân lớp d phải bão hòa
-> e hóa trị = e lớp ngoài cùng = 1
-> Cấu hình e có dạng: 1s22s22p63s23p63d104s1
-> Nguyên tố Copper (Cu)
5.11
Một hợp chất có công thức XY2, trong đó X chiếm 50% về khối lượng. Trong hạt nhân của X và Y đều có số proton bằng số neutron. Tổng số proton trong phân tử XY2 là 32. Hợp chất này được sử dụng như chất trung gian để sản xuất sulfuric acid.
a) Viết cấu hình electron của X và Y.
b) Xác định vị trị của X và Y trong sáng tuần hoàn và công thức phân tử hợp chất XY2.

Dựa vào
- Mối liên hệ giữa các hạt proton (p), neutron (n) và electron (e) trong nguyên tử:
+ Trong nguyên tử trung hòa về điện có p = e
…
- Công thức tính phần trăm khối lượng của nguyên tố X trong hợp chất XaYb:
\(\% {A_X} = \frac{{a.{A_X}}}{{{M_{{X_a}{Y_b}}}}}.100\% = \frac{{a.{A_X}}}{{a.{A_X} + b.{A_Y}}}.100\% \)
- Các bước viết cấu hình electron của nguyên tử
+ Bước 1: Xác định số electron của nguyên tử
+ Bước 2: Các electron được phân bố theo thứ tự các AO có mức năng lượng tăng dần, theo các nguyên lý và quy tắc phân bố electron trong phân tử
+ Bước 3: Viết cấu hình electron theo thứ tự các phân lớp trong một lớp và theo thứ tự của các lớp electron

a) - Gọi số hạt proton, electron và neutron trong nguyên tử X lần lượt là p1, e1, n1
- Gọi số hạt proton, electron và neutron trong nguyên tử Y lần lượt là p2, e2, n2
- Trong hạt nhân của X và Y đều có số proton bằng số neutron
=> p1 = n1 và p2 = n2
- Mà p1 = e1 và p2 = e2 => p1 = e1 = n1 và p2 = e2 = n2 (1)
- Tổng số proton trong phân tử XY2 là 32 => p1 + 2p2 = 32 (2)
- Có X chiếm 50% về khối lượng => \(\% {A_X} = \frac{{1.({p_1} + {n_1})}}{{1.({p_1} + {n_1}) + 2.({p_2} + {n_2})}}.100\% = 50\% \) (3)
- Thay (1) vào (3) ta có \(\% {A_X} = \frac{{2.{p_1}}}{{2.{p_1} + 4.{p_2}}}.100\% = 50\% \) (3’)
=> Từ (2) và (3’) giải hệ 2 phương trình 2 ẩn ta có: p1 = e1 = n1 = 16 và
p2 = e2 = n2 = 8
- Nguyên tử X có 16 electron
=> Phân mức năng lượng electron: 1s22s22p63s23p4
=> Cấu hình electron của nguyên tử X: 1s22s22p63s23p4
- Nguyên tử Y có 8 electron
=> Phân mức năng lượng electron: 1s22s22p4
=> Cấu hình electron của nguyên tử Y: 1s22s22p4
b) - Từ cấu hình electron của X: 1s22s22p63s23p4
=> Nguyên tố X là Sulfur (S) thuộc chu kì 3, nhóm VIA, ô 16 trong bảng tuần hoàn
- Từ cấu hình electron của Y: 1s22s22p4
=> Nguyên tố Y là Oxygen (O) thuộc chu kì 2, nhóm VIA, ô 8 trong bảng tuần hoàn
=> Vậy công thức phân tử của hợp chất XY2 là SO2
5.12
Hai nguyên tố X và Y đứng kế tiếp nhau trong cùng một chu kì, có tổng số điện tích hạt nhân bằng 25.
a) Hãy viết cấu hình electron của nguyên tử X, Y.
b) Xác định vị trí của X, Y trong bảng tuần hoàn và tên nguyên tố X, Y.

Dựa vào
- Hai nguyên tố đứng kế tiếp nhau trong cùng một chu kì => ta có 2 trường hợp
+ TH1: hai nguyên tố hơn kém nhau 1 đơn vị điện tích hạt nhân => p1 - p2 = 1
+ TH2: hai nguyên tố hơn kém nhau 11 đơn vị điện tích hạt nhân (điều kiện: hai nguyên tố thuộc chu kì 4 trở đi) => p1 - p2 = 11
- Trong nguyên tử trung hòa về điện có p = e
- Các bước viết cấu hình electron của nguyên tử
+ Bước 1: Xác định số electron của nguyên tử
+ Bước 2: Các electron được phân bố theo thứ tự các AO có mức năng lượng tăng dần, theo các nguyên lý và quy tắc phân bố electron trong phân tử
+ Bước 3: Viết cấu hình electron theo thứ tự các phân lớp trong một lớp và theo thứ tự của các lớp electron

a) - Gọi số hạt proton trong nguyên tử X lần lượt là p1
- Gọi số hạt proton trong nguyên tử Y lần lượt là p2
- Giả sử X đứng trước và kế tiếp Y trong cùng 1 chu kì
*Xét TH1: hai nguyên tố hơn kém nhau 1 đơn vị điện tích hạt nhân
=> p1 - p2 = 1 (1)
- Có tổng số điện tích hạt nhân bằng 25 => p1 + p2 = 25 (2)
=> Từ (1) và (2) giải hệ 2 phương trình 2 ẩn ta có p1 = 13, p2 = 12
- Nguyên tử X có 13 electron
=> Phân mức năng lượng electron: 1s22s22p63s23p1
=> Cấu hình electron của nguyên tử X: 1s22s22p63s23p1
- Nguyên tử Y có 12 electron
=> Phân mức năng lượng electron: 1s22s22p63s2
=> Cấu hình electron của nguyên tử Y: 1s22s22p63s2
*Xét TH2: hai nguyên tố hơn kém nhau 11 đơn vị điện tích hạt nhân (điều kiện: hai nguyên tố thuộc chu kì 4 trở đi) => p1 - p2 = 11 (1)
- Có tổng số điện tích hạt nhân bằng 25 => p1 + p2 = 25 (2)
=> Từ (1) và (2) giải hệ 2 phương trình 2 ẩn ta có p1 = 18, p2 = 7 => 2 nguyên tố không kế tiếp nhau => Loại
b) - Từ cấu hình electron của X: 1s22s22p63s23p1
=> Nguyên tố X là Aluminium (Al) thuộc chu kì 3, nhóm IIIA, ô 13 trong bảng tuần hoàn
- Từ cấu hình electron của Y: 1s22s22p63s2
=> Nguyên tố Y là Magnesium (Mg) thuộc chu kì 3, nhóm IIA, ô 12 trong bảng tuần hoàn
5.13
X, Y là hai nguyên tố thuộc cùng nhóm A ở hai chu kì liên tiếp trong bảng tuần hoàn, có tổng số proton trong hai hạt nhân là 32. Viết cấu hình electron của nguyên tử X và Y. Xác định tên X, Y

Dựa vào
- Hai nguyên tố thuộc cùng nhóm A và ở hai chu kì liên tiếp trong bảng tuần hoàn => ta có 4 trường hợp
+ TH1: hai nguyên tố hơn kém nhau 2 đơn vị điện tích hạt nhân (chỉ có 1H và 3Li)
+ TH2: hai nguyên tố hơn kém nhau 8 đơn vị điện tích hạt nhân (hai nguyên tố nằm trong chu kì 2, 3 và 4) => p1 - p2 = 8
+ TH3: hai nguyên tố hơn kém nhau 18 đơn vị điện tích hạt nhân (hai nguyên tố nằm trong chu kì 4, 5 và 6) => p1 - p2 = 18
+ TH4: hai nguyên tố hơn kém nhau 32 đơn vị điện tích hạt nhân (hai nguyên tố nằm trong chu kì 6 và 7) => p1 - p2 = 32
- Trong nguyên tử trung hòa về điện có p = e
- Các bước viết cấu hình electron của nguyên tử
+ Bước 1: Xác định số electron của nguyên tử
+ Bước 2: Các electron được phân bố theo thứ tự các AO có mức năng lượng tăng dần, theo các nguyên lý và quy tắc phân bố electron trong phân tử
+ Bước 3: Viết cấu hình electron theo thứ tự các phân lớp trong một lớp và theo thứ tự của các lớp electron

- Gọi số hạt proton trong nguyên tử X lần lượt là p1
- Gọi số hạt proton trong nguyên tử Y lần lượt là p2
- Giả sử X đứng trước Y, hai nguyên tố thuộc cùng nhóm A và ở hai chu kì liên tiếp trong bảng tuần hoàn => ta có 4 trường hợp
* Xét TH1: hai nguyên tố hơn kém nhau 2 đơn vị điện tích hạt nhân (chỉ có 1H và 3Li) => Loại vì tổng số proton trong hai hạt nhân là 32
* Xét TH2: hai nguyên tố hơn kém nhau 8 đơn vị điện tích hạt nhân (hai nguyên tố nằm trong chu kì 2, 3 và 4) => p1 - p2 = 8 (1)
- Tổng số proton trong hai hạt nhân là 32 => p1 + p2 = 32 (2)
=> Từ (1) và (2) giải hệ 2 phương trình 2 ẩn ta có p1 = 20, p2 = 12
- Nguyên tử X có 20 electron => X là nguyên tố Calcium (Ca)
=> Phân mức năng lượng electron: 1s22s22p63s23p64s2
=> Cấu hình electron của nguyên tử X: 1s22s22p63s23p64s2
- Nguyên tử Y có 12 electron => Y là nguyên tố Magnesium (Mg)
=> Phân mức năng lượng electron: 1s22s22p63s2
=> Cấu hình electron của nguyên tử Y: 1s22s22p63s2
*Xét TH3: hai nguyên tố hơn kém nhau 18 đơn vị điện tích hạt nhân (hai nguyên tố nằm trong chu kì 4, 5 và 6) => p1 - p2 = 18 (1)
- Tổng số proton trong hai hạt nhân là 32 => p1 + p2 = 32 (2)
=> Từ (1) và (2) giải hệ 2 phương trình 2 ẩn ta có p1 = 25, p2 = 7
- Nguyên tử X có 25 electron => X là nguyên tố Manganese (Mn)
- Nguyên tử Y có 7 electron => Y là nguyên tố Nitrogen (N)
=> Loại
*Xét TH4: hai nguyên tố hơn kém nhau 32 đơn vị điện tích hạt nhân (hai nguyên tố nằm trong chu kì 6 và 7) => Loại vì tổng số proton trong hai hạt nhân là 32
=> Vậy X là nguyên tố Calcium (Ca) và Y là nguyên tố Magnesium (Mg)
5.14
X và Y là hai nguyên tố thuộc chu kì nhỏ, thuộc hai nhóm A kế tiếp nhau trong bảng tuần hoàn. Ở trạng thái đơn chất, X và Y phản ứng được với nhau. Tổng số proton trong hạt nhân nguyên tử của X và Y là 23. Biết rằng X đứng sau Y trong bảng tuần hoàn. Xác định tên nguyên tố X, Y.

Dựa vào
- Các chu kì nhỏ là chu kì 1, 2 và 3
- Hai nguyên tố thuộc chu kì nhỏ và thuộc hai nhóm A kế tiếp nhau trong bảng tuần hoàn => ta có các trường hợp sau:
+ TH1: Hai nguyên tố cùng chu kì => p1 - p2 = 1
+ TH2: Hai nguyên tố cách nhau 1 chu kì (chu kì 1 và 2 hoặc chu kì 2 và 3)
· Chu kì 1 và 2 => Chỉ có thể là 1H và 4Be
· Chu kì 2 và 3 => p1 - p2 = 9 hoặc p1 - p2 = 7
+ TH3: Hai nguyên tố cách nhau 2 chu kì (chu kì 1 và 3)
=> Chỉ có thể là 1H và 12Mg

- Gọi số hạt proton trong nguyên tử X lần lượt là p1
- Gọi số hạt proton trong nguyên tử Y lần lượt là p2
- Hai nguyên tố thuộc chu kì nhỏ và thuộc hai nhóm A kế tiếp nhau trong bảng tuần hoàn => ta có các trường hợp sau:
*Xét TH1: Hai nguyên tố cùng chu kì => p1 - p2 = 1 (1)
- Tổng số proton trong hạt nhân nguyên tử của X và Y là 23 => p1 + p2 = 23 (2)
=> Từ (1) và (2) giải hệ 2 phương trình 2 ẩn ta có p1 = 12, p2 = 11
=> Vậy nguyên tố X là Magnesium (Mg) và nguyên tố Y là Sodium (Na)
- Tuy nhiên ở trạng thái đơn chất, Mg không phản ứng với Na ð Loại
*Xét TH2: Hai nguyên tố cách nhau 1 chu kì (chu kì 1 và 2 hoặc chu kì 2 và 3)
+ Chu kì 1 và 2 => Chỉ có thể là 1H và 4Be => Loại vì tổng số proton trong hạt nhân nguyên tử của X và Y là 23
+ Chu kì 2 và 3 => · p1 - p2 = 9 (1)
- Tổng số proton trong hạt nhân nguyên tử của X và Y là 23 => p1 + p2 = 23 (2)
=> Từ (1) và (2) giải hệ 2 phương trình 2 ẩn ta có p1 = 16, p2 = 7
=> Vậy nguyên tố X là Sulfur (S) và nguyên tố Y là Nitrogen (N)
- Tuy nhiên ở trạng thái đơn chất, S không phản ứng với N2 ð Loại
+ Chu kì 2 và 3 => · p1 - p2 = 7 (1’)
- Tổng số proton trong hạt nhân nguyên tử của X và Y là 23 => p1 + p2 = 23 (2)
=> Từ (1’) và (2) giải hệ 2 phương trình 2 ẩn ta có p1 = 15, p2 = 8
=> Vậy nguyên tố X là Phosphorus (P) và nguyên tố Y là Oxygen (O)
=> Thỏa mãn vì ở trạng thái đơn chất ta có: 4P + 5O2 2P2O5
* Xét TH3: Hai nguyên tố cách nhau 2 chu kì (chu kì 1 và 3)
=> chỉ có thể là 1H và 12Mg => Loại vì tổng số proton trong hạt nhân nguyên tử của X và Y là 23
=> Vậy nguyên tố X là Phosphorus (P) và nguyên tố Y là Oxygen (O)
5.15
Hoà tan hoàn toàn 6,645 gam hỗn hợp muối chloride của hai kim loại kiềm thuộc hai chu kì kế tiếp nhau vào nước được dung dịch X. Cho toàn bộ dung dịch X tác dụng hoàn toàn với dung dịch AgNO3 (dư), thu được 18,655 gam kết tủa. Xác định 2 kim loại kiềm.

Dựa vào
- Kim loại kiềm là kim loại nhóm IA => Công thức tổng quát của hỗn hợp muối chloride là \(\overline R Cl\)
- Viết phương trình phản ứng: \(\overline R Cl\) + AgNO3 => \(\overline R N{O_3}\) + AgCl$
- Đặt mol, tìm dữ kiện liên quan và giải nghiệm

- Gọi công thức tổng quát của hỗn hợp muối chloride là RCl (x mol)
- Có PTHH: \(\overline R Cl\) + AgNO3 -> \(\overline R N{O_3}\) + AgCl
x -> x (mol)
- Có nmuối = x = \(\frac{{6,645}}{{{M_{\overline R }} + 35,5}}\); nkết tủa = x = \(\frac{{18,655}}{{108 + 35,5}}\)
=> \(\frac{{6,645}}{{{M_{\overline R }} + 35,5}}\) = \(\frac{{18,655}}{{108 + 35,5}}\) => \({M_{\overline R }}\) = 15,62
- Vì hai kim loại kiềm thuộc hai chu kì kế tiếp nhau
=> MLi (7) < \({M_{\overline R }}\) = 15,62 < MNa (23)
=> Vậy hai kim loại kiềm là Lithium (Li) và Sodium (Na)
