1.1
Nguyên tử là phần tử nhỏ nhất của chất và
A. không mang điện.
B. mang điện tích dương.
C. mang điện tích âm.
D. có thể mang điện hoặc không mang đến

Dựa vào đặc điểm của nguyên tử: Nguyên tử có kích thước vô cùng nhỏ và trung hòa về điện

- Đáp án: A
1.2
Phát biểu nào sau đây không đúng?
A. Chỉ có hạt nhân nguyên tử oxygen mới có 8 proton.
B. Chỉ có hạt nhân nguyên tử oxygen mới có 8 neutron.
C. Chỉ có nguyên tử oxygen mới có 8 electron.
D. Cả A và C.

Dựa vào
- Đặc điểm: hạt nhân mỗi nguyên tử chỉ chứa số lượng proton đặc trưng cho nguyên tử của nguyên tố đó
- Số p = số e

- Đáp án: B
1.3
Số hiệu nguyên tử cho biết
A. số proton trong hạt nhân nguyên tử hoặc số đơn vị điện tích hạt nhân nguyên tử.
B. số electron trong lớp vỏ nguyên tử.
C. số thứ tự của nguyên tố trong bảng tuần hoàn.
D. cả A, B và C đều đúng.

Dựa vào ý nghĩa của số hiệu nguyên tử: Số hiệu nguyên tử cho biết:
- Số proton trong hạt nhân nguyên tử hoặc số đơn vị điện tích hạt nhân nguyên tử.
- Số electron trong lớp vỏ nguyên tử.
- Số thứ tự của nguyên tố trong bảng tuần hoàn.

- Đáp án: D
1.4
Cấu hình electron nào sau đây là của nguyên tử fluorine (Z = 9)?
A 1s22s22p3
B. 1s22s22p4
C. 1s22s32p4
D. 1s22s22p5

Viết cấu hình electron của nguyên tử
- Bước 1: Xác định số electron của nguyên tử
- Bước 2: Các electron được phân bố theo thứ tự các AO có mức năng lượng tăng dần, theo các nguyên lý và quy tắc phân bố electron trong phân tử
- Bước 3: Viết cấu hình electron theo thứ tự các phân lớp trong một lớp và theo thứ tự của các lớp electron

- Nguyên tử F có 9 electron
=> Phân mức năng lượng electron: 1s22s22p5
=> Cấu hình electron của nguyên tử F: 1s22s22p5
=> Đáp án: D
1.5
Nguyên tử của nguyên tố phosphorus (Z = 15) có số electron độc thân là
A.1
B. 2.
C. 3.
D. 4.

Viết cấu hình electron của nguyên tử
- Bước 1: Xác định số electron của nguyên tử
- Bước 2: Các electron được phân bố theo thứ tự các AO có mức năng lượng tăng dần, theo các nguyên lý và quy tắc phân bố electron trong phân tử
- Bước 3: Viết cấu hình electron theo thứ tự các phân lớp trong một lớp và theo thứ tự của các lớp electron
=> Viết cấu hình electron theo ô lượng tử của nguyên tử
=> Xác định số electron độc thân

- Nguyên tử P có 15 electron
=> Phân mức năng lượng electron: 1s22s22p63s23p3
=> Cấu hình electron của nguyên tử P: 1s22s22p63s23p3
=> Cấu hình electron theo ô lượng tử của nguyên tử P:
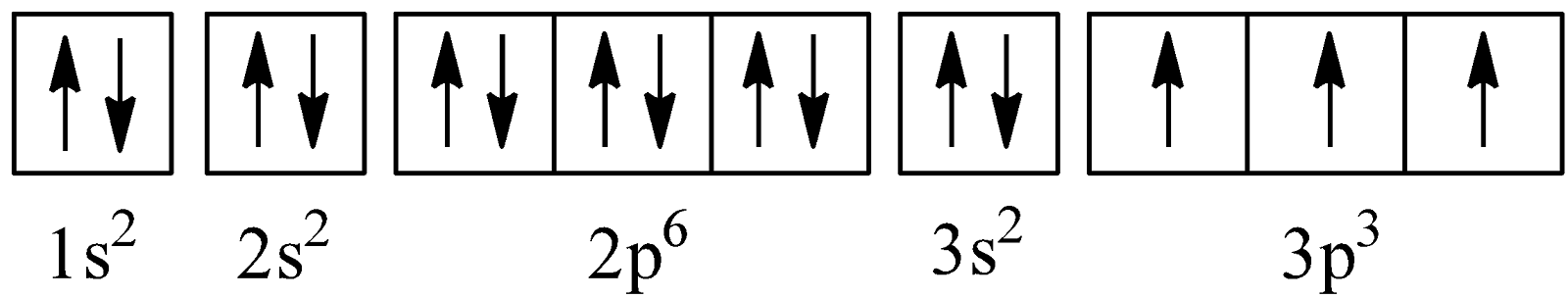
=> Nguyên tử P có 3 electron độc thân
1.6
Trong từ nhiên, bromine có 2 đồng vị \({}_{35}^{79}Br\) có hàm lượng 50,7% và \({}_{35}^{81}Br\) có hàm lượng 49,3%. Tính nguyên tử khối trung bình của bromine.

Dựa vào công thức tính nguyên tử khối trung bình của nguyên tố X:
\(\overline A {}_X = \frac{{{a_1}.A{}_1 + {a_2}.{A_2} + ... + {a_i}.{A_i}}}{{100}}\)
Trong đó:
- \(\overline A {}_X\)là nguyên tử khối trung bình của X
- Ai là nguyên tử khối đồng vị thứ i
- ai là tỉ lệ % số nguyên tử đồng vị thứ i

- Nguyên tử khối trung bình của bromine là
\(\overline M {}_{Br} = \frac{{50,7.79 + 49,3.81}}{{100}}\)= 79,986 (g/mol)
1.7
Lithium trong tự nhiên có 2 đồng vị là \({}_3^7Li\) và \({}_3^6Li\). Nguyên tử khối trung bình của lithium là 6,94. Tinh thành phần phần trăm của mỗi đồng vị lithium trong tự nhiên.
Advertisements (Quảng cáo)

Dựa vào công thức tính nguyên tử khối trung bình của nguyên tố X:
\(\overline A {}_X = \frac{{{a_1}.A{}_1 + {a_2}.{A_2} + ... + {a_i}.{A_i}}}{{100}}\)
Trong đó:
- \(\overline A {}_X\)là nguyên tử khối trung bình của X
- Ai là nguyên tử khối đồng vị thứ i
- ai là tỉ lệ % số nguyên tử đồng vị thứ i

- Gọi thành phần phần trăm của đồng vị \({}_3^7Li\) là x (%)
=> Thành phần phần trăm của đồng vị \({}_3^6Li\) là 100-x (%)
- Áp dụng công thức tính nguyên tử khối trung bình ta có:
\(\overline M {}_{Li} = \frac{{x.7 + (100 - x).6}}{{100}}\)= 6,94 ” x = 94%
=> Vậy thành phần phần trăm của đồng vị \({}_3^7Li\) là 94% và thành phần phần trăm của đồng vị \({}_3^6Li\) là 100 - 94 = 6%
1.8
Điện tích của electron là -1,602.10-19 C (coulomb). Tính điện tích của hạt nhân nguyên tử carbon theo đơn vị coulomb.

Dựa vào
- Điện tích của electron là -1,602.10-19 C (coulomb)
- Điện tích hạt nhân = số proton = số electron
- Điện tích hạt nhân (tính theo coulomb) = số proton x 1,602.10-19 C

- Nguyên tử carbon có Z = 6
=> Điện tích hạt nhân (tính theo coulomb) = 6 x 1,602.10-19 C = 9,612.10-19 C
1.9
Hợp chất Y có công thức MX2 (là hợp chất được sử dụng làm cơ chế đánh lửa bằng bánh xe trong các dạng súng cổ), trong đó M chiếm 46,67% về khối lượng. Trong hạt nhân M có số neutron nhiều hơn số proton là 4 hạt. Trong hạt nhân nguyên tử X, số neutron bằng số proton. Tổng số proton trong MX2 là 58.
a) Tìm AM và AX
b) Xác định công thức phân tử của MX2

Dựa vào
- Mối liên hệ giữa các hạt proton (p), neutron (n) và electron (e) trong nguyên tử:
+ Số neutron nhiều hơn số proton là X hạt ” n - p = X
+ Trong nguyên tử trung hòa về điện có p = e
+ Số khối A = p + n
- Công thức tính phần trăm khối lượng của nguyên tố X trong hợp chất XaYb:
\(\% {A_X} = \frac{{a.{A_X}}}{{{M_{{X_a}{Y_b}}}}}.100\% = \frac{{a.{A_X}}}{{a.{A_X} + b.{A_Y}}}.100\% \)

a) - Gọi số hạt proton, electron và neutron trong nguyên tử M lần lượt là p1, e1, n1
- Gọi số hạt proton, electron và neutron trong nguyên tử X lần lượt là p2, e2, n2
- Trong hạt nhân M có số neutron nhiều hơn số proton là 4 hạt ” n1 - p1 = 4 (1)
- Trong hạt nhân nguyên tử X, số neutron bằng số proton ” n2 = p2 (2)
- Tổng số proton trong MX2 là 58 ” p1 + 2.p2 = 58 (3)
- Nguyên tử M chiếm 46,67% về khối lượng
=> \(\% {A_M} = \frac{{1.{A_M}}}{{1.{A_M} + 2.{A_X}}}.100\% = \frac{{{p_1} + {n_1}}}{{{p_1} + {n_1} + 2.({p_2} + {n_2})}}.100\% \) = 46,67% (4)
=> Từ (1), (2), (3), (4) giải hệ 4 phương trình 4 ẩn ta có: p1 = 26, n1 = 30,
p2 = n2 = 16
=> Vậy AM = 26 + 30 = 56, AX = 16 + 16 = 32
b) Công thức phân tử của MX2 là FeS2
1.10
Hợp chất có công thức phân tử M2X (được ứng dụng trong sản xuất xi măng, phần bón) có tổng số hạt là 140. Trong đó, số hạt mang điện nhiều hơn số hạt không mang điện là 44. Số khối của nguyên tử M lớn hơn số khối của nguyên tử X là 23. Tổng số hạt trong nguyên tử M nhiều hơn trong nguyên tử X là 34. Viết cấu hình electron của các nguyên tử M và X. Viết công thức phân tử của hợp chất M2X

Dựa vào mối liên hệ giữa các hạt proton (p), neutron (n) và electron (e) trong nguyên tử:
- Tổng số hạt trong nguyên tử = p + n + e
- Trong nguyên tử trung hòa về điện có p = e
- Số hạt không mang điện = n
- Proton mang điện tích dương, electron mang điện tích âm
- Số khối A = p + n
*Viết cấu hình electron của nguyên tử
- Bước 1: Xác định số electron của nguyên tử
- Bước 2: Các electron được phân bố theo thứ tự các AO có mức năng lượng tăng dần, theo các nguyên lý và quy tắc phân bố electron trong phân tử
- Bước 3: Viết cấu hình electron theo thứ tự các phân lớp trong một lớp và theo thứ tự của các lớp electron

- Gọi số hạt proton, electron và neutron trong nguyên tử M lần lượt là p1, e1, n1
- Gọi số hạt proton, electron và neutron trong nguyên tử X lần lượt là p2, e2, n2
- Có tổng số hạt là 140 ” 2.(p1 + e1 + n1) + p2 + e2 + n2 = 140 (1)
- Trong đó, số hạt mang điện nhiều hơn số hạt không mang điện là 44
=> (2.(p1 + e1) + p2 + e2) - (2.n1 + n2) = 44 (2)
- Số khối của nguyên tử M lớn hơn số khối của nguyên tử X là 23
=> (p1 + n1) - (p2 + n2) = 23 (3)
- Tổng số hạt trong nguyên tử M nhiều hơn trong nguyên tử X là 34
=> (p1 + e1 + n1) - (p2 + e2 + n2)= 34 (4)
=> Từ (1), (4) giải hệ hai phương trình hai ẩn (p1 + e1 + n1) và (p2 + e2 + n2)ta có
(p1 + e1 + n1) = 58 (5) và (p2 + e2 + n2) = 24 (6)
- Có p1 = e1 và p2 = e2 thay vào các phương trình (2), (5), (6) ta được
(2’) (2.2p1 + 2p2) - (2.n1 + n2) = 44
(5’) 2p1 + n1 = 58
(6’) 2p2 + n2 = 24
=> Từ (2’), (3), (5’), (6’) giải hệ bốn phương trình bốn ẩn ta có p1 = e1 = 19,
n1 = 20, p2 = e2 = 8, n2 = 8
- Nguyên tử M có 19 electron ” M là nguyên tố Potassium (K)
=> Phân mức năng lượng electron: 1s22s22p63s23p64s1
=> Cấu hình electron của nguyên tử M: 1s22s22p63s23p64s1
- Nguyên tử X có 8 electron ” X là nguyên tố Oxygen (O)
=> Phân mức năng lượng electron: 1s22s22p4
=> Cấu hình electron của nguyên tử X: 1s22s22p4
=> Vậy công thức phân tử của hợp chất M2X là K2O
