Bài 7.25 trang 70 SBT Hóa Học 10 Nâng cao
Một bình kín chứa khí NH3 ở 00C và 1 atm với nồng độ 1 mol/l. Nung bình kín đó đến 5460C và NH3 bị phân hủy theo phản ứng:
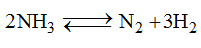
Khi phản ứng trên đạt tới cân bằng, áp suất khí trong bình là 3,3 atm. Thể tích bình không đổi. Tính hằng số cân bằng của phản ứng phân hủy amoniac ở 5460C.

Áp suất tăng lên vì hai lí do: nhiệt độ tăng và số mol khí tăng. Nhiệt độ từ 00C (tức là 273K) tăng lên 5460C (tức 819K) nghĩa là nhiệt độ tuyệt đối tăng lên 3 lần. Như vậy số mol khí chỉ tăng \({{3,3} \over 3} = 1,1\) lần.
Giả sử ban đầu trong bình chứa n mol khí NH3 và x mol chất đó đã bị phân hủy:
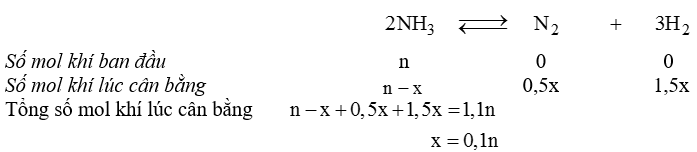
Advertisements (Quảng cáo)
Nồng độ lúc cân bằng:
\(\left[ {{N_2}} \right] = {{0,5.0,1n} \over V} = 0,05\) (mol/l).
\(\left[ {{H_2}} \right] = {{1,5.0,1n} \over V} = 0,15\,\,\left( {mol/l} \right).\)
\(\left[ {N{H_3}} \right] = {{n - 0,1n} \over V} = 0,9\,\,\left( {mol/l} \right).\)
Lưu ý: \({n \over V}\) = nồng độ ban đầu của NH3 \(\to {n \over V} = 1\)
Hằng số cân bằng:
\(K = {{\left[ {{N_2}} \right].{{\left[ {{H_2}} \right]}^3}} \over {{{\left[ {N{H_3}} \right]}^2}}} = {{0,05.{{\left( {0,15} \right)}^3}} \over {{{\left( {0,9} \right)}^2}}} = 2,{08.10^{ - 4}}\)
