Bài 7.30 trang 71 SBT Hóa Học 10 Nâng cao
Axit axetic tác dụng với ancol isopropylic theo phản ứng thuận nghịch:
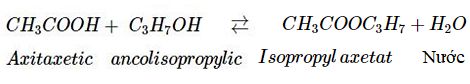
Nếu ban đầu người ta cho 1 mol axit axetic tác dụng với 1 mol ancol isopropylic thì cân bằng sẽ đạt được khi có 0,6 mol isopropyl axetat được tạo thành.
Lúc đó người ta thêm 1 mol axit axetic vào hỗn hợp phản ứng, cân bằng sẽ bị phá vỡ và chuyển dịch đến trạng thái cân bằng mới.
Hỏi khi cân bằng mới được thiết lập, số mol mỗi chất trong hỗn hợp là bao nhiêu?

Để tạo r a 0,6 mol isopropylic axetat cần tiêu hao 0,6 mol axit axetic, 0,6 mol ancol isopropylic. Lượng nước tao ra cũng là 0,6 mol. Khi cân bằng lần thứ nhất được thiết lập, nồng độ mol các chất trong hỗn hợp như sau:
\(\left[ {C{H_3}{\rm{COO}}{{\rm{C}}_3}{H_7}} \right] = {{0,6} \over V}\,\left( {mol/l} \right)\) \(\left[ {{H_2}O} \right] = {{0,6} \over V}\,\left( {mol/l} \right)\)
\(\left[ {C{H_3}{\rm{COOH}}} \right] = {{0,4} \over V}\,\,\left( {mol/l} \right)\) \(\left[ {{C_3}{H_7}OH} \right] = {{0,4} \over V}\,\,\left( {mol/l} \right)\)
(V là thể tích của hỗn hợp phản ứng)
Hằng số cân bằng:
\(K = {{\left[ {C{H_3}{\rm{COO}}{{\rm{C}}_3}{H_7}} \right].\left[ {{H_2}O} \right]} \over {\left[ {C{H_3}COOH} \right].\left[ {{C_3}{H_7}OH} \right]}} = {{0,36} \over {0,16}} \)\(= 2,25\)
Khi thêm 1 mol axit axetic vào hỗn hợp đang cân bằng thì cân bằng sẽ chuyển dịch.
\(C{H_3}COOH\,\,\,\, + \,\,\,{C_3}{H_7}OH\,\,\,\,\, \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over
{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}}\)\( \,\,\,\,\,C{H_3}COO{C_3}{H_7}\,\,\,\, + \,\,\,\,{H_2}O\)
|
Lúc bắt đầu thêm axit |
1,4 mol |
0,4 mol |
0,6 mol |
0,6 mol |
|
Biến đổi |
Advertisements (Quảng cáo) - x mol |
- x mol |
+ x mol |
+ x mol |
|
Lúc có cân bằng mới |
(1,4 – x) mol |
(0,4 – x) mol |
(0,6 + x) mol |
(0,6 + x) mol |
Khi cân bằng mới được thiết lập lại, nồng độ mol các chất như sau:
\(\left[ {C{H_3}COO{C_3}{H_7}} \right] = {{0,6 + x} \over {V’}}\) \(\left[ {{H_2}O} \right] = {{0,6 + x} \over {V’}}\)
\(\left[ {C{H_3}COOH} \right] = {{1,4 - x} \over {V’}}\) \(\left[ {{C_3}{H_7}OH} \right] = {{0,4 - x} \over {V’}}\)
(V’ là thể tích của hỗn hợp phản ứng lúc đó).
Hằng số cân bằng của phản ứng vẫn là 2,25 nên ta có:
\(\eqalign{
& {{{{\left( {0,6 + x} \right)}^2}} \over {\left( {1,4 - x} \right)\left( {0,4 - x} \right)}} = 2,25\,\, \cr
& \buildrel {\,\,} \over
\longrightarrow \,\,1,25{x^2} - 525x + 0,9 = 0 \cr} \)
Phương trình này có hai nghiệm: \({x_1} = 4,02\) và \({x_2} = 0,18\)
Chỉ có nghiệm x = 0,18 là thích hợp vì 1,4 - 4,02 < 0 là vô lí. Vậy khi cân bằng được thiết lập trở lại, hỗn hợp phản ứng có:
1,4 – 0,18 = 1,22 (mol CH3COOH);
0,4 – 0,18 = 0,22 (mol C3H7OH);
0,6 + 0,18 = 0,78 (mol CH3COOC3H7) và 0,78 mol H2O.
