Câu hỏi/bài tập:
Trong một bình kín xảy ra cân bằng hoá học sau:
\[{{\rm{H}}_2}\left( g \right){\rm{ }} + {\rm{ }}{{\rm{I}}_2}\left( g \right){\rm{ }} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2{\rm{HI}}\left( g \right)\]
Cho 1 mol H2 và 1 mol I2 vào bình kín, dung tích 2 lít. Lượng HI tạo thành theo thời gian được biểu diễn bằng đồ thị sau:
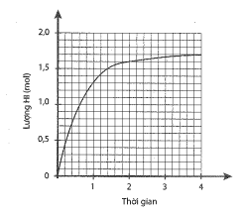
a) Xác định nồng độ các chất ở thời điểm cân bằng.
b) Tính hằng số cân bằng KC.
c) Tính hiệu suất của phản ứng.

a) Ở trạng thái cân bằng, nồng độ các chất không thay đổi.
b) Tổng quát, nếu có phản ứng thuận nghịch sau:aA+bB \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \) cC +dD
Khi phản ứng ở trạng thái cân bằng, ta có: \[{{\rm{K}}_{\rm{C}}}{\rm{ = }}\frac{{{{{\rm{[C]}}}^{\rm{c}}}{{{\rm{[D]}}}^{\rm{d}}}}}{{{{{\rm{[A]}}}^{\rm{a}}}{{{\rm{[B]}}}^{\rm{b}}}}}\]
Trong đó [A], [B], [C] và [D] là nồng độ mol các chất A, B, C và D ở trạng thái cân bằng; a, b, c và d là hệ số tỉ lượng các chất trong phương trìn
a) Ở trạng thái cân bằng, nồng độ các chất không thay đổi.
b) Tổng quát, nếu có phản ứng thuận nghịch sau:aA+bB \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \) cC +dD
Khi phản ứng ở trạng thái cân bằng, ta có: \[{{\rm{K}}_{\rm{C}}}{\rm{ = }}\frac{{{{{\rm{[C]}}}^{\rm{c}}}{{{\rm{[D]}}}^{\rm{d}}}}}{{{{{\rm{[A]}}}^{\rm{a}}}{{{\rm{[B]}}}^{\rm{b}}}}}\]
Advertisements (Quảng cáo)
Trong đó [A], [B], [C] và [D] là nồng độ mol các chất A, B, C và D ở trạng thái cân bằng; a, b, c và d là hệ số tỉ lượng các chất trong phương trình hoá học. Chất rắn không xuất hiện trong biểu thức hằng số cân bằng.
c) Tính hiệu suất dựa vào H2 hoặc I2.
h hoá học. Chất rắn không xuất hiện trong biểu thức hằng số cân bằng.
c) Tính hiệu suất dựa vào H2 hoặc I2.

a) Ta có: \[{{\rm{C}}_{{{\rm{H}}_{\rm{2}}}}} = {{\rm{C}}_{{{\rm{I}}_{\rm{2}}}}} = \frac{1}{2} = 0,5{\rm{ }}({\rm{M}})\];
Dựa vào đồ thị, ta thấy tại thời điểm cân bằng: \[{{\rm{n}}_{{\rm{HI}}}} = 1,7{\rm{ }}({\rm{mol}}) \Rightarrow [{\rm{HI}}] = \frac{{1,7}}{2} = 0,85{\rm{ }}({\rm{M}})\]
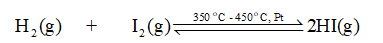
Ban đầu (M): 0,5 0,5 0
Phản ứng (M): 0,425 ← 0,425 ← 0,85
Cân bằng (M): 0,075 0,075 0,85
Vậy \[{\rm{[}}{{\rm{H}}_{\rm{2}}}{\rm{] = [}}{{\rm{I}}_{\rm{2}}}{\rm{] = 0,5}} - 0,425 = 0,075{\rm{ (M); [HI] = 0,85 (M)}}\]
b) \[{{\rm{K}}_{\rm{C}}}{\rm{ = }}\frac{{{{{\rm{[HI]}}}^{\rm{2}}}}}{{{\rm{[}}{{\rm{H}}_{\rm{2}}}{\rm{][}}{{\rm{I}}_{\rm{2}}}{\rm{]}}}} = \frac{{0,{{85}^2}}}{{0,075 \times 0,075}} \approx 128,444\]
c) Ta có: \[{{\rm{C}}_{{{\rm{I}}_{\rm{2}}}{\rm{ bdau}}}} = 0,5{\rm{ }}({\rm{M}});{\rm{ }}{{\rm{C}}_{{{\rm{I}}_{\rm{2}}}{\rm{ p/u}}}} = 0,425{\rm{ }}({\rm{M}})\]
\[ \Rightarrow {\rm{H}} = \frac{{0,425}}{{0,5}} \times 100\% = 85\% \]
