Câu hỏi trang 75 Mở đầu
Kim loại giữ vai trò quan trọng trong các ngành kỹ thuật vì chúng có những tính chất vật lí, hoá học đặc biệt. Kim loại có cấu tạo nguyên tử như thế nào? Có những tính chất và ứng dụng gì?

Nêu cấu tạo nguyên tử, tính chất và ứng dụng của kim loại.

- Cấu tạo nguyên tử: Trong cùng chu kì, nguyên tử của nguyên tố kim loại có bán kính nguyên tử lớn hơn và điện tích hạt nhân nhỏ hơn so với nguyên tử của nguyên tố phi kim. Đa số các nguyên tử kim loại có số electron ở lớp ngoài cùng là 1,2, 3.
- Tính chất:
+ Tính chất vật lý chung: tính ánh kim, tính dẫn điện, tính dẫn nhiệt và tính dẻo.
+ Tính chất hóa học:
· Kim loại tác dụng với phi kim.
· Kim loại tác dụng với dung dịch acid.
· Kim loại tác dụng với nước.
· Kim loại tác dụng với dung dịch muối.
- Ứng dụng: một số kim loại được dùng làm đồ trang sức hay làm các vật dụng trang trí; kim loại có tính dẫn điện tốt được dùng làm dây dẫn điện như Cu, Al; kim loại có tính dẫn nhiệt tốt có thể được dùng làm dụng cụ đun nấu…
Câu hỏi trang 75 Tranh luận
Hãy nêu nhận xét về số electron lớp ngoài cùng của các nguyên tử kim loại Na, Mg, Al, Fe, Cu, Zn.

Đa số các nguyên tử kim loại có số electron ở lớp ngoài cùng là 1,2, 3.

Các nguyên tử kim loại trên có số electron ở lớp ngoài cùng là 1 (như Na, Cu), 2 (như Mg, Fe, Zn), 3 (như Al).
Câu hỏi trang 76
So sánh liên kết kim loại với liên kết ion và liên kết cộng hoá trị.

- Trong tinh thể kim loại, lực hút tĩnh điện giữa các ion dương ở nút mạng với các electron hoá trị chuyển động tự do tạo nên liên kết kim loại.
- Liên kết ion là liên kết được tạo thành bằng lực hút tĩnh điện của các ion mang điện tích trái dấu (trong phân tử hay tinh thể). Các ion được sắp xếp theo trật tự nhất định trong không gian theo kiểu mạng lưới (ở các nút mạng là các ion dương và ion âm xếp luân phiên liên kết chặt chẽ với nhau do cân bằng lực hút và lực đẩy).
- Liên kết cộng hóa trị là liên kết được hình thành giữa hai nguyên tử bằng một hay nhiều cặp electron dùng chung.


* So sánh liên kết kim loại với liên kết cộng hóa trị:
- Giống nhau: có sự dùng chung electron.
- Khác nhau:
+ Liên kết cộng hóa trị: dùng chung electron giữa hai nguyên tử tham gia liên kết.
+ Liên kết kim loại: dùng chung toàn bộ electron hóa trị trong nguyên tử kim loại.
* So sánh liên kết kim loại với liên kết ion.
- Giống nhau: đều là liên kết sinh ra bởi lực hút tĩnh điện.
- Khác nhau:
+ Liên kết ion: do lực hút tĩnh điện giữa hai ion mang điện tích trái dấu.
+ Liên kết kim loại: lực hút tĩnh điện sinh ra do các electron tự do trong kim loại và ion dương kim loại.
Câu hỏi trang 77 Tranh luận 1
Vàng, bạc được sử dụng làm đồ trang sức nhờ tính chất vật lý nào của kim loại?

Kim loại có ánh kim vì electron tự do trong tinh thể kim loại phản xạ ánh sáng trong vùng nhìn thấy. Nhờ có ánh kim, một số kim loại được dùng làm đồ trang sức hay làm các vật dụng trang trí.

Vàng, bạc được sử dụng làm đồ trang sức nhờ tính chất vật lý ánh kim và tính dẻo của kim loại.
Câu hỏi trang 77 Tranh luận 2
Hãy cho biết hiện tượng xảy ra khi tác dụng một lực cơ học đủ mạnh lên tấm kim loại. Giải thích.

Kim loại có tính dẻo là nhờ electron tự do liên kết các lớp mạng trong tinh thể với nhau và chúng có thể trượt lên nhau khi chịu tác dụng của một lực cơ học nhưng không tách rời nhau.

Khi tác dụng một lực cơ học đủ mạnh lên tấm kim loại, kim loại sẽ bị biến dạng vì kim loại có tính dẻo nhờ electron tự do liên kết các lớp mạng trong tinh thể với nhau và chúng có thể trượt lên nhưng không tách rời nhau.
Câu hỏi trang 78 Luyện tập
Hãy giải thích:
a) Tại sao tungsten (W) được dùng để làm dây tóc bóng đèn?
b) Tại sao lõi dây điện thường được làm từ kim loại đồng?

Kim loại có nhiệt độ nóng chảy cao nhất là W (3 410 °C).
Kim loại dẫn điện tốt nhất là Ag, sau đó đến Cu, Au, Al, Fe,...

a) Người ta sử dụng tungsten (W) được dùng để làm dây tóc bóng đèn vì tungsten là kim loại có nhiệt độ nóng chảy cao nhất.
b) Đồng có tính dẫn điện tốt (chỉ sau bạc), giá thành rẻ hơn bạc nên được sử dụng để làm lõi dây điện.
Câu hỏi trang 78 Tranh luận
Tiến hành Thí nghiệm 1 và nêu hiện tượng xảy ra. Xác định vai trò của các chất trong các phản ứng hoá học xảy ra ở thí nghiệm này.

Hầu hết các kim loại (trừ Au, Pt,...) có thể phản ứng với chlorine tạo thành muối chloride.
Hầu hết các kim loại có thể phản ứng với oxygen (trừ Ag, Au, Pt) tạo thành các oxide tương ứng.
Nhiều kim loại có thể khử lưu huỳnh tạo thành các muối sulfide tương ứng. Phản ứng cần đun nóng (trừ Hg).

- Hiện tượng phản ứng của thí nghiệm sắt phản ứng với chlorine: Sắt cháy sáng tạo thành khói màu nâu đỏ.
Advertisements (Quảng cáo)
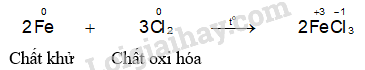
- Hiện tượng phản ứng của thí nghiệm magnesium phản ứng với oxygen: Magnesium cháy sáng chói, toả nhiều nhiệt.
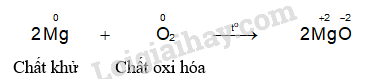
- Hiện tượng phản ứng của thí nghiệm sắt phản ứng với lưu huỳnh: Khi đốt nóng hỗn hợp, lưu huỳnh nóng chảy, hỗn hợp cháy sáng và bắt đầu chuyển thành hợp chất màu đen, phản ứng tỏa nhiều nhiệt.
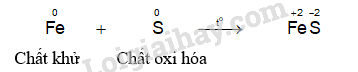
Câu hỏi trang 79 Tranh luận 1
Dựa vào thế điện cực chuẩn trong Bảng 12.1, hãy cho biết kim loại nào có khả năng phản ứng được với dung dịch HCl hoặc dung dịch H2SO4 loãng giải phóng khí H2.

Kim loại có \({\rm{E}}_{{{\rm{M}}^{{\rm{n + }}}}{\rm{/M}}}^{\rm{o}}\)< 0 có thể phản ứng với dung dịch HCl, dung dịch H2SO4 loãng, sinh ra khí H2.

Những kim loại có \({\rm{E}}_{{{\rm{M}}^{{\rm{n + }}}}{\rm{/M}}}^{\rm{o}}\)< 0 có khả năng phản ứng được với dung dịch HCl hoặc dung dịch H2SO4 loãng giải phóng khí H2: Li, K, Ba, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb.
Câu hỏi trang 79 Tranh luận 2
Tiến hành Thí nghiệm 2 và nêu hiện tượng xảy ra. Xác định vai trò của các chất trong phản ứng hoá học xảy ra ở Thí nghiệm 2.

Tiến hành Thí nghiệm 2 và nêu hiện tượng xảy ra. Xác định vai trò của các chất trong phản ứng hoá học xảy ra ở Thí nghiệm 2.

- Ống nghiệm (1): Không hiện tượng.
- Ống nghiệm (2): Xuất hiện bọt khí không màu, sắt tan dần và dung dịch chuyển sang màu xanh nhạt.

- Ống nghiệm (3): Không hiện tượng.
- Ống nghiệm (4): Xuất hiện bọt khí không màu, sắt tan dần và dung dịch chuyển sang màu xanh nhạt.
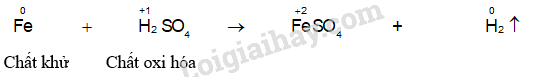
- Ống nghiệm (5): Mẩu kim loại đồng tan dần, xuất hiện bọt khí không màu, mùi hắc, dung dịch chuyển sang màu xanh lam.

Câu hỏi trang 80 Tranh luận 1
Dựa vào thế điện cực chuẩn trong Bảng 12.1, hãy cho biết kim loại nào có khả năng phản ứng được với nước ở điều kiện thường giải phóng khí H2.

Kim loại có \({\rm{E}}_{{{\rm{M}}^{{\rm{n + }}}}{\rm{/M}}}^{\rm{o}}\)< -0,42 có thể phản ứng với H2O tạo thành base và khí H2.

Kim loại có thể phản ứng với H2O ở điều kiện thường giải phóng khí H2: Li, K, Ba, Ca, Na.
Câu hỏi trang 80 Tranh luận 2
Dựa vào thế điện cực chuẩn trong Bảng 12.1, hãy cho biết kim loại nào có khả năng đẩy được đồng ra khỏi dung dịch CuSO4 1 M.

Nếu \({\rm{E}}_{{{\rm{M}}^{{\rm{n + }}}}{\rm{/M}}}^{\rm{o}}\)< \({\rm{E}}_{{{\rm{A}}^{{\rm{m + }}}}{\rm{/A}}}^{\rm{o}}\)thì kim loại M có thể phản ứng với dung dịch Am+ 1M.

Kim loại có \({\rm{E}}_{{{\rm{M}}^{{\rm{n + }}}}{\rm{/M}}}^{\rm{o}}\) < 0,34 và không phản ứng với nước ở điều kiện thường, có khả năng đẩy được đồng ra khỏi dung dịch CuSO4 1 M là Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb.
Câu hỏi trang 80 Tranh luận 3
Tiến hành Thí nghiệm 3 và nêu hiện tượng xảy ra. Xác định vai trò của các chất trong phản ứng hoá học xảy ra ở Thí nghiệm 3.

Kim loại có thế điện cực chuẩn nhỏ hơn có khả năng khử được ion kim loại có thế điện cực chuẩn lớn hơn trong dung dịch muối ở điều kiện chuẩn.

- Ống nghiệm (1): Kết tủa màu xám bạc bám vào mẩu đồng. Dung dịch ban đầu không màu chuyển dần sang màu xanh.
\(\mathop {{\rm{Cu}}}\limits^0 {\rm{ }} + {\rm{ }}2\mathop {{\rm{Ag}}}\limits^{{\rm{ + 1}}} {\rm{N}}{{\rm{O}}_3}{\rm{ }} \to {\rm{ }}\mathop {{\rm{Cu(}}}\limits^{ + 2} {\rm{N}}{{\rm{O}}_3}{)_{\rm{2}}}{\rm{ + 2}}\mathop {{\rm{Ag}}}\limits^0 \downarrow \)
Chất khử Chất oxi hóa
- Ống nghiệm (2): Không hiện tượng.
Câu hỏi trang 80 Bài tập 1
Thuỷ ngân dễ bay hơi và rất độc. Khi nhiệt kế thuỷ ngân bị vỡ có thể dùng bột lưu huỳnh để xử lý thuỷ ngân. Giải thích.

Nhiều kim loại có thể khử lưu huỳnh tạo thành các muối sulfide tương ứng. Phản ứng cần đun nóng (trừ Hg).

Khi nhiệt kế thuỷ ngân bị vỡ có thể dùng bột lưu huỳnh để xử lý thuỷ ngân vì lưu huỳnh phản ứng với thủy ngân ngay ở nhiệt độ thường, tạo ra chất rắn HgS không độc, có thể quét dọn được.
\({\rm{Hg}} + {\rm{S}} \to {\rm{HgS}} \downarrow \)
Câu hỏi trang 80 Bài tập 2
Tại sao đồng dẫn điện tốt hơn nhôm nhưng dây điện cao thế thường được làm bằng nhôm mà không làm bằng đồng? cho biết khối lượng riêng của đồng là 8,96 g/cm3, của nhôm là 2,70 g/cm3.

Dựa vào khối lượng riêng của nhôm và đồng để trả lời câu hỏi.

Dây điện cao thế thường sử dụng nhôm vì nhôm nhẹ hơn đồng, làm giảm áp lực lên cột điện, cột điện đỡ bị gãy. Ngoài ra, giá nhôm cũng rẻ hơn so với đồng.
Câu hỏi trang 80 Bài tập 3
Để làm tinh khiết bột đồng có lẫn các kim loại thiếc, kẽm, người ta có thể ngâm hỗn hợp trên vào lượng dư dung dịch Cu(NO3)2. Giải thích và viết phương trình hoá học của các phản ứng xảy ra (nếu có).

Kim loại có thế điện cực chuẩn nhỏ hơn có khả năng khử được ion kim loại có thế điện cực chuẩn lớn hơn trong dung dịch muối ở điều kiện chuẩn.

- Giải thích: Các kim loại thiếc, kẽm đều có thế điện cực chuẩn nhỏ hơn đồng nên thiếc và kẽm có thể đẩy được đồng ra khỏi dung dịch muối đồng. Vì vậy để làm tinh khiết bột đồng có lẫn các kim loại thiếc, kẽm, người ta có thể ngâm hỗn hợp trên vào lượng dư dung dịch Cu(NO3)2. Thiếc và kẽm tan trong dung dịch Cu(NO3)2, tạo thêm kết tủa đồng, lọc hỗn hợp ta thu được kim loại đồng tinh khiết.
- Phương trình hóa học:
\(\begin{array}{l}{\rm{Sn }} + {\rm{ Cu(N}}{{\rm{O}}_3}{{\rm{)}}_2} \to {\rm{ Sn(N}}{{\rm{O}}_3}{)_{\rm{2}}}{\rm{ + Cu}} \downarrow \\{\rm{Zn }} + {\rm{ Cu(N}}{{\rm{O}}_3}{{\rm{)}}_2} \to {\rm{ Zn(N}}{{\rm{O}}_3}{)_{\rm{2}}}{\rm{ + Cu}} \downarrow \end{array}\)
