Câu hỏi trang 70 Mở đầu
Pin điện hoá hoạt động dựa trên các phản ứng oxi hoá - khử tự xảy ra trong pin (hoá năng chuyển thành điện năng). Tuy nhiên, một số phản ứng oxi hoá - khử chỉ có thể xảy ra nhờ năng lượng dòng điện, được gọi là phản ứng điện phân (điện năng chuyểnthành hoá năng).
Khi điện phân, các quá trình trên bề mặt điện cực xảy ra theo nguyên tắc nào? Điện phân có ứng dụng gì trong đời sống, sản xuất?

Nêu nguyên tắc, ứng dụng của điện phân.

- Nguyên tắc điện phân:
+ Nguyên tắc điện phân nóng chảy:
• Tại cathode (điện cực âm): xảy ra quá trình khử ion dương.
• Tại anode (điện cực dương): xảy ra quá trình oxi hoá ion âm.
+ Nguyên tắc điện phân dung dịch: ở cathode, ưu tiên điện phân chất có tính oxi hoá mạnh hơn; ở anode, ưu tiên điện phân chất có tính khử mạnh hơn.
- Ứng dụng: điều chế, tinh chế một số kim loại, mạ điện,...
Câu hỏi trang 70 Tranh luận 1
Xác định sản phẩm tạo thành ở hai điện cực khi điện phân NaCl nóng chảy.

Nguyên tắc điện phân nóng chảy:
• Tại cathode (điện cực âm): xảy ra quá trình khử ion dương.
• Tại anode (điện cực dương): xảy ra quá trình oxi hoá ion âm.

Sản phẩm tạo thành ở hai điện cực khi điện phân NaCl nóng chảy:
- Cathode: Na.
- Anode: Cl2.
Câu hỏi trang 70 Luyện tập
Viết phương trình hoá học của quá trình điện phân nóng chảy các chất: MgCl2, Al2O3.

Nguyên tắc điện phân nóng chảy:
• Tại cathode (điện cực âm): xảy ra quá trình khử ion dương.
• Tại anode (điện cực dương): xảy ra quá trình oxi hoá ion âm.

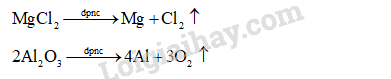
Câu hỏi trang 71 Tranh luận 1
Tiến hành Thí nghiệm 1 và nêu hiện tượng quan sát được.

Dựa vào phương trình điện phân để nêu hiện tượng:
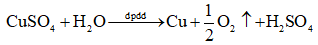

Hiện tượng: kim loại đồng (màu đỏ) bám vào cathode, sủi bọt khí không màu (O2) thoát ra ở anode.
Câu hỏi trang 71 Tranh luận 2
Cho biết khi điện phân dung dịch CuSO4 ion Cu2+ và \({\rm{SO}}_4^{2 - }\) di chuyển về điện cực nào.

Nguyên tắc điện phân dung dịch: ở cathode, ưu tiên điện phân chất có tính oxi hoá mạnh hơn; ở anode, ưu tiên điện phân chất có tính khử mạnh hơn.

- Ion Cu2+ di chuyển về điện cực âm (cathode).
- Ion \({\rm{SO}}_4^{2 - }\) di chuyển về điện cực dương (anode).
Câu hỏi trang 72 Tranh luận
Tiến hành Thí nghiệm 2 và nêu hiện tượng xảy ra. Giải thích.

Dựa vào phương trình điện phân để nêu hiện tượng:
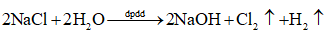
Dựa vào sơ đồ điện phân để giải thích.

- Hiện tượng: ở cả hai điện cực đều thoát ra khí không màu.
- Giải thích: Xét sơ đồ điện phân
Cathode (-) NaCl Anode (+)
Advertisements (Quảng cáo)
Na+, H2O H2O Cl-, H2O
\({\rm{2}}{{\rm{H}}_{\rm{2}}}{\rm{O}} + 2{\rm{e}} \to 2{\rm{O}}{{\rm{H}}^ - } + {{\rm{H}}_2}\) \(2{\rm{C}}{{\rm{l}}^ - } \to {\rm{C}}{{\rm{l}}_2} + 2{\rm{e}}\)
Câu hỏi trang 72 Luyện tập
Viết quá trình xảy ra ở mỗi điện cực và phương trình hoá học của phản ứng điện phân khi điện phân dung dịch: AgNO3; CuCl2 với điện cực graphite.

Nguyên tắc điện phân dung dịch: ở cathode, ưu tiên điện phân chất có tính oxi hoá mạnh hơn; ở anode, ưu tiên điện phân chất có tính khử mạnh hơn.

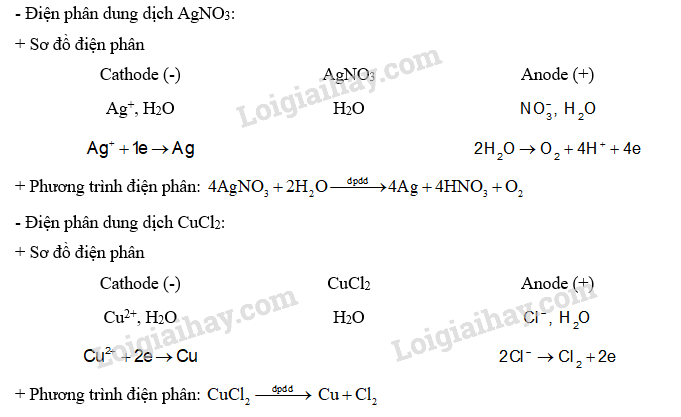
Câu hỏi trang 73
Em hãy tìm hiểu và nêu một số ứng dụng của phương pháp điện phân trong thực tiễn.

Nêu các ứng dụng của điện phân trong thực tiễn từ thông tin trong SGK.

- Sản xuất kim loại: Trong công nghiệp, các kim loại mạnh (Na, K, Ca, Mg, Al,…) được điều chế bằng phương pháp điện phân nóng chảy, các kim loại yếu và trung bình được điều chế bằng phương pháp điện phân dung dịch.
- Tinh chế kim loại: các kim loại từ nguồn kim loại thô được tinh chế bằng phương pháp điện phân.
- Mạ điện: ion kim loại bị khử, tạo thành lớp kim loại rắn bao phủ trên bề mặt kim loại cần mạ nhằm trang trí bề mặt hoặc chống sự ăn mòn.
Câu hỏi trang 74 Bài tập 1
Điện phân CaCl2 nóng chảy, ở cathode xảy ra quá trình nào?
A. Oxi hoá ion Ca2+. B. Khử ion Ca2+.
C. Oxi hoá ion Cl-. D. Khử ion Cl-.

Nguyên tắc điện phân nóng chảy:
• Tại cathode (điện cực âm): xảy ra quá trình khử ion dương.
• Tại anode (điện cực dương): xảy ra quá trình oxi hoá ion âm.

Điện phân CaCl2 nóng chảy, ở cathode xảy ra quá trình khử Ca2+: \({\rm{C}}{{\rm{a}}^{2 + }} + 2{\rm{e}} \to {\rm{Ca}}\)
→ Chọn B.
Câu hỏi trang 74 Bài tập 2
Điện phân dung dịch Cu(NO3)2 với điện cực trơ, ở anode xảy ra quá trình nào?
\(\begin{array}{l}{\rm{A}}{\rm{. }}{{\rm{H}}_{\rm{2}}}{\rm{O }} \to \frac{1}{2}{{\rm{O}}_{\rm{2}}}{\rm{ + 2}}{{\rm{H}}^{\rm{ + }}}{\rm{ + 2e}}{\rm{.}}\\{\rm{B}}{\rm{. 2}}{{\rm{H}}_{\rm{2}}}{\rm{O + 2e}} \to {{\rm{H}}_{\rm{2}}}{\rm{ + 2O}}{{\rm{H}}^ - }.\\{\rm{C}}{\rm{. Cu}} \to {\rm{C}}{{\rm{u}}^{{\rm{2 + }}}}{\rm{ + 2e}}{\rm{.}}\\{\rm{D}}{\rm{. C}}{{\rm{u}}^{{\rm{2 + }}}}{\rm{ + 2e}} \to {\rm{Cu}}.\end{array}\)

Nguyên tắc điện phân dung dịch: ở cathode, ưu tiên điện phân chất có tính oxi hoá mạnh hơn; ở anode, ưu tiên điện phân chất có tính khử mạnh hơn.

Ở anode, ion \({\rm{NO}}_3^ - \)không bị điện phân, H2O bị điện phân:
\({\rm{2}}{{\rm{H}}_{\rm{2}}}{\rm{O}} \to {{\rm{O}}_2} + 4{{\rm{H}}^ + } + 4{\rm{e}}\)hay có thể viết \({{\rm{H}}_{\rm{2}}}{\rm{O }} \to \frac{1}{2}{{\rm{O}}_{\rm{2}}}{\rm{ + 2}}{{\rm{H}}^{\rm{ + }}}{\rm{ + 2e}}\)
→ Chọn A.
Câu hỏi trang 74 Bài tập 3
Viết phương trình hoá học của phản ứng điện phân khi điện phân KCl nóng chảy.

Nguyên tắc điện phân nóng chảy:
• Tại cathode (điện cực âm): xảy ra quá trình khử ion dương.
• Tại anode (điện cực dương): xảy ra quá trình oxi hoá ion âm.

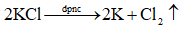
Câu hỏi trang 74 Bài tập 4
Hãy đề xuất và trình bày cách mạ đồng (Cu) lên một đồ vật làm từ sắt (Fe) bằng phương pháp điện phân.

Mạ điện: ion kim loại bị khử, tạo thành lớp kim loại rắn bao phủ trên bề mặt kim loại cần mạ nhằm trang trí bề mặt hoặc chống sự ăn mòn.

- Sử dụng bình mạ điện chứa dung dịch CuCl2, thanh kim loại đồng (anode) và vật dụng bằng sắt (cathode).
- Trong bình mạ điện sẽ xảy ra các quá trình khử anode (+): \({\rm{C}}{{\rm{u}}^{{\rm{2 + }}}}{\rm{ + 2e}} \to {\rm{Cu}}\)
Đồng tan và bám vào cathode (vật dụng bằng sắt).
