Cacbon phản ứng được với tất cả các chất trong dãy sau:
A. CO2, Na2O, H2 B. O2, ZnO, Al2O3
C. CO2, CuO, H2 D. O2, CaO, Fe2O3
Phương pháp: Xem lại tính chất của cacbon Tại đây
 Đáp án đúng: C
Đáp án đúng: C
Khí than ướt là nguyên liệu và nhiên liệu trong công nghiệp, được sản xuất bằng cách dẫn hơi nước qua than nóng đỏ, thu được khí CO và H2.
a) Viết phương trình hóa học
b) Tính khối lượng than cần thiết để sản xuất 22,400 m3 khí than ướt ở đktc.
Hiệu suất của cả quá trình là 75%
Phương pháp:
\(\eqalign{
& a)\,C + {H_2}O\buildrel {{t^0}} \over
\longrightarrow CO + {H_2} \cr
& b)\,{n_C} = n{}_{CO} \cr
& \,\,\,\,\,H\% = {{m\,{\,_{thuc\,\,te}}} \over {m\,{\,_{li\,\,thuyet}}}}.100\% \cr} \)

a) Phương trình hóa học:
\(C + {H_2}O\buildrel {{t^0}} \over
\longrightarrow CO + {H_2}\)
b) Khối lượng than cần thiết để sản xuất 22,400 m3 khí than ướt ở đktc:
\({n_{CO}} = {{22,400.1000} \over {22,4}} = 1000\,\,(mol)\)
Theo phương trình: nC = nCO = 1000 mol
Khối lượng than cần thiết với hiệu suất 75% là:
\({m_C} = {{1000.12.100} \over {75}} = 16000\,(gam) = 16kg\)
Dùng cacbon dư khử hoàn toàn hỗn hợp hai oxit CuO và Fe2O3 ở nhiệt độ cao thu được a gam chất rắn A. Cho A phản ứng với dung dịch HCl dư thu được 0,448 lít khí và còn lại chất rắn không tan B. Dùng H2SO4 đặc, nóng hòa tan hoàn toàn B thì thu được 0,224 lít khí không màu, mùi hắc.
a) Viết các phương trình hóa học
b) Tính thành phần phần trăm của hỗn hợp hai oxit. Các khí đều đo ở đktc.
Phương pháp:
a) PTHH:
Advertisements (Quảng cáo)
$$\eqalign{
& C + 2CuO\buildrel {{t^0}} \over
\longrightarrow 2Cu + C{O_2}\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,(1) \cr
& 3C + 2F{e_2}{O_3}\buildrel {{t^0}} \over
\longrightarrow 4Fe + 3C{O_2}\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,(2) \cr
& Fe + 2HCl\mathrel{\mathop{\kern0pt\longrightarrow}
\limits_{}} FeC{l_2} + {H_2}\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,(3) \cr
& Cu + 2{H_2}S{O_{4\,\,dac}}\buildrel {{t^0}} \over
\longrightarrow CuS{O_4} + S{O_2} + 2H{}_2O\,\,\,(4) \cr} $$
b) nH2= 0,02 mol; nSO2 = 0,01 mol
Theo PTHH ta có:
nCuO =nCu = nSO2=0,01 mol
nFe2O3=2nFe=2.nH2=0,02 mol
Tổng khối lượng hai oxit = mCuO + mFe2O3
=>% khối lượng mỗi oxit

a) Các PTHH:
$$\eqalign{
& C + 2CuO\buildrel {{t^0}} \over
\longrightarrow 2Cu + C{O_2}\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,(1) \cr
& 3C + 2F{e_2}{O_3}\buildrel {{t^0}} \over
\longrightarrow 4Fe + 3C{O_2}\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,(2) \cr
& Fe + 2HCl\mathrel{\mathop{\kern0pt\longrightarrow}
\limits_{}} FeC{l_2} + {H_2}\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,(3) \cr
& Cu + 2{H_2}S{O_{4\,\,dac}}\buildrel {{t^0}} \over
\longrightarrow CuS{O_4} + S{O_2} + 2H{}_2O\,\,\,(4) \cr} $$
b) Thành phần phần trăm hỗn hợp hai oxit:
nH2= 0,02 mol; nSO2 = 0,01 mol
Theo PTHH ta có:
nCuO =nCu = nSO2=0,01 mol => mCuO = 0,8 gam
nFe2O3=2nFe=2.nH2=0,02 mol=> mFe2O3=3,2 gam
Tổng khối lượng hai oxit = mCuO + mFe2O3= 3,2+0,8 = 4 gam
=>% mCuO= (0,8:4).100=20%
% mFe2O3= 100-20=80%
Hãy điền nội dung thích hợp vào ô trống trong bảng sau:
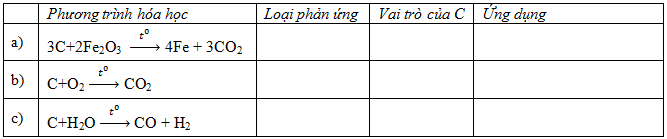
Phương pháp: Xem lại tính chất của cacbon Tại đây

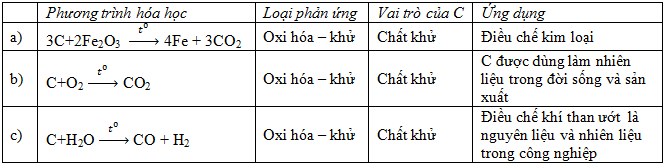
();
}
}
});
