12.1
Số oxi hoá của nguyên tử S trong hợp chất SO2 là
A. +2.
B. +4.
C. +6.
D. -1.

- Quy tắc 2: Trong một phân tử, tổng số oxi hóa của các nguyên tử bằng 0
- Quy tắc 4:
+ Trong đa số các hợp chất, số oxi hóa của hydrogen bằng +1, trừ các hydride kim loại như (NaH, CaH2,…)
+ Số oxi hóa của oxygen bằng -2, trừ OF2 và các peroxide, superoxide như (H2O2, Na2O2, KO2,…)

- Đặt x là số oxi hóa của S
- Trong SO2, ta có: x.1 + (-2).2 = 0 => x = +4
=> Đáp án: B
12.2
Dấu hiệu đề nhận ra phản ứng là phản ứng oxi hoá – khử dựa trên sự thay đổi đại lượng nào sau đây của nguyên tử?
A. Số mol.
B. Số oxi hoá.
C. Số khối.
D. Số proton.

Dựa vào định nghĩa phản ứng oxi hóa - khử: là phản ứng hóa học, trong đó có sự chuyển dịch electron giữa các chất, phản ứng hay có sự thay đổi số oxi hóa của một số nguyên tử trong phân tử.

- Đáp án: B
12.3
Calcium chloride dùng trong điện phân đề sản xuất calcium kim loại và điều chế các hợp kim của calcium. Với tính chất hút ẩm lớn, calcium chloride được dùng làm tác nhân sấy khí và chất lỏng. Do nhiệt độ đông đặc thấp nên dung dịch calcium(II) chloride được dùng làm chất tải lạnh trong các hệ thống lạnh,... Ngoài ra, calcium chloride còn được làm chất keo tụ trong hoá dược và dược phẩm hay trong công việc khoan dầu khí.

Trong phản ứng tạo thành calcium(II) chloride từ đơn chất: Ca + Cl2 -> CaCl2. Kết luận nào sau đây đúng?
A. Mỗi nguyên tử calcium nhận 2e.
B. Mỗi nguyên tử chlorine nhận 2e.
C. Mỗi phân tử chlorine nhường 2e.
D. Mỗi nguyên tử calcium nhường 2e.

- Bước 1: Xác định số oxi hóa của các nguyên tử có sự thay đổi số oxi hóa trong phản ứng
=> Xác định chất oxi hóa, chất khử
- Bước 2: Viết quá trình oxi hóa và quá trình khử

- Bước 1: \(\mathop {Ca}\limits^0 + \mathop {C{l_2}}\limits^0 \to \mathop {Ca}\limits^{ + 2} \mathop {C{l_2}}\limits^{ - 1} \)
=> Ca là chất khử, Cl2 là chất oxi hóa
- Bước 2:
+ Quá trình oxi hóa: \(\mathop {Ca}\limits^0 \to \mathop {Ca}\limits^{ + 2} + 2e\)
+ Quá trình khử: \(\mathop {C{l_2}}\limits^0 + 2.1e \to 2\mathop {Cl}\limits^{ - 1} \)
=> Đáp án: D
12.4
Phản ứng nào sau đây có sự thay đổi số oxi hoá của nguyên tố calcium?
A. Ca(OH)2 + CuCl2 → Cu(OH)2 + CaCl2
B. CaCl2 → Ca + Cl2
C. 3CaCl2 + 2K3PO4 → Ca3(PO4)2 + 6KCl
D. CaO + 2HCl → CaCl2 + H2O

Xác định số oxi hóa của các nguyên tử calcium trong các phản ứng

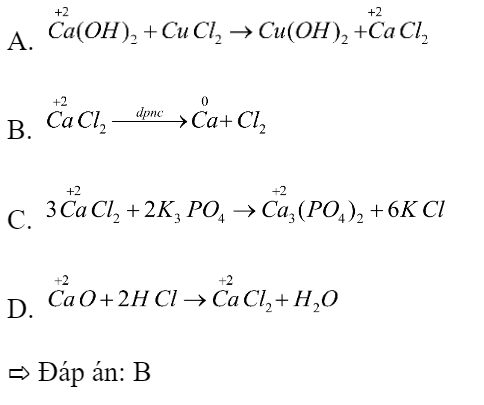
12.5
Cho các phản ứng sau
(a) Ca(OH)2 + Cl2 -> CaOCl2 + H2O
(b) 2NO2 + 2NaOH -> NaNO3 + NaNO2 + H2O
(c) O3 + 2Ag -> Ag2O + O₂
(d) 2H2S + SO2 -> 3S + 2H2O
(e) 4KClO3 -> KCl + 3KClO4
Số phản ứng oxi hoá – khử là
A. 2.
B. 3.
C. 5.
D. 4.

Dựa vào định nghĩa phản ứng oxi hóa - khử: là phản ứng hóa học, trong đó có sự chuyển dịch electron giữa các chất, phản ứng hay có sự thay đổi số oxi hóa của một số nguyên tử trong phân tử.

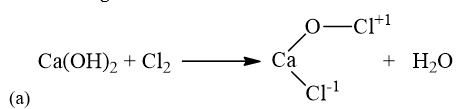
(b) \(2\mathop N\limits^{ + 4} {O_2} + 2NaOH \to Na\mathop N\limits^{ + 5} {O_3} + Na\mathop N\limits^{ + 3} {O_2} + {H_2}O\)
(c) \(\mathop {{O_3}}\limits^0 + 2\mathop {Ag}\limits^0 \to \mathop {A{g_2}}\limits^{ + 1} \mathop O\limits^{ - 2} + {O_2}\)
(d) \(2{H_2}\mathop S\limits^{ - 2} + \mathop S\limits^{ + 4} {O_2} \to 3\mathop S\limits^0 + 2{H_2}O\)
(e) \(4K\mathop {Cl}\limits^{ + 5} {O_3} \to K\mathop {Cl}\limits^{ - 1} + 3K\mathop {Cl}\limits^{ + 7} {O_4}\)
12.6
Phương trình phản ứng nào sau đây không thể hiện tính khử của ammonia (NH3)?
A. 4NH3 + 5O2 -> 4NO + 6H2O
B. NH3 + HCl -> NH4Cl
C. 2NH3 + 3Cl2 -> 6HCl + N2
D. 4NH3 + 3O2 -> 2N2 + 6H2O

- Xác định số oxi hóa của các nguyên tử nitrogen và hydrogen trong các phản ứng.
- Để NH3 thể hiện tính khử thì nguyên tử nitrogen hoặc hydrogen trong NH3 cần tăng số oxi hóa trong phản ứng

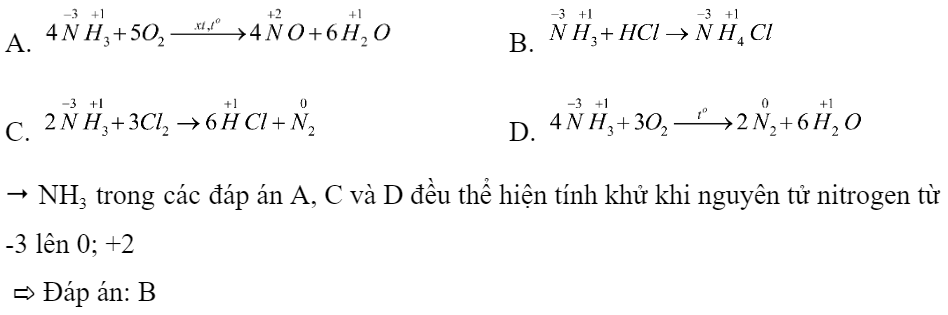
12.7
Trong phản ứng: 3Cu + 8HNO3 ” 3Cu(NO3)2 + 2NO + 4H2O. Số phân tử - nitric acid (HNO3) đóng vai trò chất oxi hoá là
A. 8.
B. 6.
C. 4.
D. 2.

- Bước 1: Xác định số oxi hóa của các nguyên tử có sự thay đổi số oxi hóa trong phản ứng
=> Xác định chất oxi hóa, chất khử
- Bước 2: Viết quá trình oxi hóa và quá trình khử
- Bước 3: Xác định (và nhân) hệ số thích hợp vào các quá trình sao cho tổng số electron chất khử nhường bằng tổng số electron chất oxi hóa nhận

- Bước 1: \(3\mathop {Cu}\limits^0 + 8H\mathop N\limits^{ + 5} {O_3} \to 3\mathop {Cu}\limits^{ + 2} {(N{O_3})_2} + 2\mathop N\limits^{ + 2} O + 4{H_2}O\)
=> Cu là chất khử, HNO3 là chất oxi hóa
- Bước 2:
+ Quá trình oxi hóa: \(\mathop {Cu}\limits^0 \to \mathop {Cu}\limits^{ + 2} + 2e\)
+ Quá trình khử: \(\mathop N\limits^{ + 5} + 3e \to \mathop N\limits^{ + 2} \)
- Bước 3:
|
3x |
\(\mathop {Cu}\limits^0 \to \mathop {Cu}\limits^{ + 2} + 2e\) |
|
2x |
\(\mathop N\limits^{ + 5} + 3e \to \mathop N\limits^{ + 2} \) |
=> Có 2 phân tử HNO3 đóng vai trò là chất oxi hóa
=> Đáp án: D
12.8
Trong thiên nhiên manganesium là nguyên tố tương đối phổ biến, đứng thứ ba trong các kim loại chuyển tiếp, chỉ sau Fe và Ti. Các khoáng vật chính của manganesium là hausmanite (Mn3O4), pyrolusite (MnO2), braunite (Mn2O3) và manganite (MnOOH). Manganesium tồn tại ở rất nhiều trạng thái oxi hoá khác nhau từ +2 tới +7.
Cho các chất sau: Mn, MnO2, MnCl2, KMnO4 Số oxi hoá của nguyên tố Mn trong các chất lần lượt là
A. 2, -2, -4, +8.
B. 0, +4, +2, +7.
C. 0, +4, -2, +7.
D. 0, +2, -4, -7.

- Quy tắc 1: Số oxi hóa của nguyên tử trong các đơn chất bằng 0
- Quy tắc 2: Trong một phân tử, tổng số oxi hóa của các nguyên tử bằng 0
- Quy tắc 3: Trong các ion, số oxi hóa của nguyên tử (đối với ion đơn nguyên tử) hay tổng số oxi hóa các nguyên tử (đối với ion đa nguyên tử) bằng điện tích của ion đó
- Quy tắc 4:
+ Trong đa số các hợp chất, số oxi hóa của hydrogen bằng +1, trừ các hydride kim loại như (NaH, CaH2,…)
+ Số oxi hóa của oxygen bằng -2, trừ OF2 và các peroxide, superoxide như (H2O2, Na2O2, KO2,…)
+ Kim loại kiềm (nhóm IA) luôn có số oxi hóa +1
+ Kim loại kiềm thổ (nhóm IIA) luôn có số oxi hóa +2
+ Nhôm (aluminium) có số oxi hóa +3
+ Số oxi hóa của nguyên tử fluorine trong các hợp chất bằng -1

Đặt x là số oxi hóa của Mn
- Trong Mn: Các nguyên tử trong các đơn chất sẽ luôn có số oxi hóa là 0 ” x = 0
- Trong MnO2: x.1 + (-2).2 = 0 ” x = +4
- Trong MnCl2: x.1 + (-1).2 = 0 ” x = +2
- Trong KMnO4: +1.1 + x.1 + (-2).4 = 0 ” x = +7
=> Đáp án: B
12.9
Trong thiên nhiên manganesium là nguyên tố tương đối phổ biến, đứng thứ ba trong các kim loại chuyển tiếp, chỉ sau Fe và Ti. Các khoáng vật chính của manganesium là hausmanite (Mn3O4), pyrolusite (MnO2), braunite (Mn2O3) và manganite (MnOOH). Manganesium tồn tại ở rất nhiều trạng thái oxi hoá khác nhau từ +2 tới +7.
Phản ứng nào sau đây không có sự thay đổi số oxi hoá của nguyên tố Mn?
A. MnO2 + 4HCl -> MnCl2 + Cl2 + 2H2O
B. Mn + O2 -> MnO2
C. 2HCl + MnO -> MnCl2 + H2O
D. 6KI + 2KMnO4 + 4H2O -> 3I2 + 2MnO2 + 8KOH

Xác định số oxi hóa của các nguyên tử Mn trong phản ứng

A. \(\mathop {Mn}\limits^{ + 4} {O_2} + 4HCl \to \mathop {Mn}\limits^{ + 2} C{l_2} + C{l_2} + 2{H_2}O\)
B. \(\mathop {Mn}\limits^0 + {O_2} \to \mathop {Mn}\limits^{ + 4} {O_2}\)
C. \(2HCl + \mathop {Mn}\limits^{ + 2} O \to \mathop {Mn}\limits^{ + 2} C{l_2} + {H_2}O\)
D. \(6KI + 2K\mathop {Mn}\limits^{ + 7} {O_4} + 4{H_2}O \to 3{I_2} + 2\mathop {Mn}\limits^{ + 4} {O_2} + 8KOH\)
=> Đáp án: C
12.10
Trong thiên nhiên manganesium là nguyên tố tương đối phổ biến, đứng thứ ba trong các kim loại chuyển tiếp, chỉ sau Fe và Ti. Các khoáng vật chính của manganesium là hausmanite (Mn3O4), pyrolusite (MnO2), braunite (Mn2O3) và manganite (MnOOH). Manganesium tồn tại ở rất nhiều trạng thái oxi hoá khác nhau từ +2 tới +7.
Sục khí SO2 vào dung dịch KMnO4 (thuốc tím), màu tím nhạt dần rồi mất màu (biết sản phẩm tạo thành là MnSO4, H2SO4 và H2O). Nguyên nhân là do
A. SO2 đã oxi hoá KMnO4 thành MnO2.
B. SO2 đã khử KMnO4 thành Mn2+.
C. KMnO4 đã khử SO2 thành S+6.
D. H2O đã oxi hoá KMnO4 thành Mn2+.

Xác định số oxi hóa của các nguyên tử có sự thay đổi số oxi hóa trong phản ứng => Xác định chất oxi hóa, chất khử

- Dựa vào sản phẩm và các chất tham gia ta thấy
\(\mathop S\limits^{ + 4} \to \mathop S\limits^{ + 6} + 2e\)
\(\mathop {Mn}\limits^{ + 7} + 5e \to \mathop {Mn}\limits^{ + 2} \)
=> SO2 là chất khử, KMnO4 là chất oxi hóa
=> SO2 đã khử KMnO4 thành Mn2+ ð Đáp án: B
12.11
Xác định số oxi hoá của các nguyên tố trong các chất và ion sau:
a) Fe, N2, SO3, H2SO4, CuS, Cu2S, Na2O2, H3AsO4.
b) Br2, O3, HClO3, KClO4, NaClO, NH4NO3, N2O, NaNO2.
c) Br-, PO43-, MnO4-, ClO3-, H2PO4-, SO42-, NH4+.
d) MnO2, K2MnO4, K2Cr2O7, K2CrO4, Cr2(SO4)3, NaCrO2.
e) FeS2, FeS, FeO, Fe2O3, Fe3O4, FexOy.

- Quy tắc 1: Số oxi hóa của nguyên tử trong các đơn chất bằng 0
- Quy tắc 2: Trong một phân tử, tổng số oxi hóa của các nguyên tử bằng 0
- Quy tắc 3: Trong các ion, số oxi hóa của nguyên tử (đối với ion đơn nguyên tử) hay tổng số oxi hóa các nguyên tử (đối với ion đa nguyên tử) bằng điện tích của ion đó
- Quy tắc 4:
+ Trong đa số các hợp chất, số oxi hóa của hydrogen bằng +1, trừ các hydride kim loại như (NaH, CaH2,…)
+ Số oxi hóa của oxygen bằng -2, trừ OF2 và các peroxide, superoxide như (H2O2, Na2O2, KO2,…)
+ Kim loại kiềm (nhóm IA) luôn có số oxi hóa +1
+ Kim loại kiềm thổ (nhóm IIA) luôn có số oxi hóa +2
+ Nhôm (aluminium) có số oxi hóa +3
+ Số oxi hóa của nguyên tử fluorine trong các hợp chất bằng -1

Số oxi hóa của các nguyên tố trong các chất và ion theo thứ tự lần lượt là:
a) \(\mathop {Fe}\limits^0 ,{\rm{ }}\mathop {{N_2}}\limits^0 ,{\rm{ }}\mathop S\limits^{ + 6} \mathop {{O_3}}\limits^{ - 2} ,{\rm{ }}\mathop {{H_2}}\limits^{ + 1} \mathop S\limits^{ + 6} \mathop {{O_4}}\limits^{ - 2} ,{\rm{ }}\mathop {Cu}\limits^{ + 2} \mathop S\limits^{ - 2} ,{\rm{ }}\mathop {C{u_2}}\limits^{ + 1} \mathop S\limits^{ - 2} ,{\rm{ }}\mathop {N{a_2}}\limits^{ + 1} \mathop {{O_2}}\limits^{ - 1} ,{\rm{ }}\mathop {{H_3}}\limits^{ + 1} \mathop {As}\limits^{ + 5} \mathop {{O_4}}\limits^{ - 2} \)
b) \(\mathop {B{r_2}}\limits^0 ,{\rm{ }}\mathop {{O_3}}\limits^0 ,{\rm{ }}\mathop {\rm{H}}\limits^{ + 1} \mathop {Cl}\limits^{ + 5} \mathop {{O_3}}\limits^{ - 2} ,{\rm{ }}\mathop K\limits^{ + 1} \mathop {Cl}\limits^{ + 7} \mathop {{O_4}}\limits^{ - 2} ,{\rm{ }}\mathop {{\rm{Na}}}\limits^{ + 1} \mathop {Cl}\limits^{ + 1} \mathop O\limits^{ - 2} ,{\rm{ }}\mathop {\rm{N}}\limits^{ - 3} \mathop {{{\rm{H}}_{\rm{4}}}}\limits^{ + 1} \mathop N\limits^{ + 5} \mathop {{O_3}}\limits^{ - 2} ,{\rm{ }}\mathop {{N_2}}\limits^{ + 1} \mathop O\limits^{ - 2} ,{\rm{ }}\mathop {Na}\limits^{ + 1} \mathop N\limits^{ + 3} \mathop {{O_2}}\limits^{ - 2} \)
c) \(\mathop {B{r^ - }}\limits^{ - 1} ,{\rm{ }}\mathop P\limits^{ + 5} \mathop {{O_4}^{3 - }}\limits^{ - 2} ,{\rm{ }}\mathop {Mn}\limits^{ + 7} \mathop {{O_4}^ - }\limits^{ - 2} ,{\rm{ }}\mathop {Cl}\limits^{ + 5} \mathop {{O_3}^ - }\limits^{ - 2} ,{\rm{ }}\mathop {{H_2}}\limits^{ + 2} \mathop P\limits^{ + 5} \mathop {{O_4}^ - }\limits^{ - 2} ,{\rm{ }}\mathop S\limits^{ + 6} \mathop {{O_4}^{2 - }}\limits^{ - 2} ,{\rm{ }}\mathop N\limits^{ - 3} \mathop {{H_4}^ + }\limits^{ + 1} \)
d) \(\mathop {Mn}\limits^{ + 4} \mathop {{O_2}}\limits^{ - 2} ,{\rm{ }}\mathop {{K_2}}\limits^{ + 1} \mathop {Mn}\limits^{ + 6} \mathop {{O_4}}\limits^{ - 2} ,{\rm{ }}\mathop {{{\rm{K}}_{\rm{2}}}}\limits^{ + 1} \mathop {C{r_2}}\limits^{ + 6} \mathop {{O_7}}\limits^{ - 2} ,{\rm{ }}\mathop {{K_2}}\limits^{ + 1} \mathop {{\rm{Cr}}}\limits^{ + 6} \mathop {{O_4}}\limits^{ - 2} ,{\rm{ }}\mathop {C{r_2}}\limits^{ + 3} {(\mathop S\limits^{ + 6} \mathop {{O_4}}\limits^{ - 2} )_3},{\rm{ }}\mathop {Na}\limits^{ + 1} \mathop {Cr}\limits^{ + 3} \mathop {{O_2}}\limits^{ - 2} \)
e) \(\mathop {Fe}\limits^{ + 2} \mathop {{S_2}}\limits^{ - 1} ,{\rm{ }}\mathop {Fe}\limits^{ + 2} \mathop S\limits^{ - 2} ,{\rm{ }}\mathop {Fe}\limits^{ + 2} \mathop O\limits^{ - 2} ,{\rm{ }}\mathop {F{e_2}}\limits^{ + 3} \mathop {{O_3}}\limits^{ - 2} ,{\rm{ }}\mathop {F{e_3}}\limits^{ + \frac{8}{3}} \mathop {{O_4}}\limits^{ - 2} ,{\rm{ }}\mathop {F{e_x}}\limits^{ + \frac{{2y}}{x}} \mathop {{O_y}}\limits^{ - 2} \)
12.12
Viết các quá trình nhường hay nhận electron của các biến đổi trong các dãy sau:
a) \(\mathop S\limits^{ - 2} \to \mathop S\limits^0 \to \mathop S\limits^{ + 4} \to \mathop S\limits^{ + 6} \to \mathop S\limits^{ + 4} \)
b) \(\mathop N\limits^{ - 3} \to \mathop N\limits^0 \to \mathop N\limits^{ + 2} \to \mathop N\limits^{ + 4} \to \mathop N\limits^{ + 5} \to \mathop N\limits^{ + 2} \)

- Quá trình nhường electron: làm tăng số oxi hóa của nguyên tử
- Quá trình nhận electron: làm giảm số oxi hóa của nguyên tử

a) \(\mathop S\limits^{ - 2} \to \mathop S\limits^0 + 2e\); \(\mathop S\limits^0 \to \mathop S\limits^{ + 4} + 4e\); \(\mathop S\limits^{ + 4} \to \mathop S\limits^{ + 6} + 2e\); \(\mathop S\limits^{ + 6} + 2e \to \mathop S\limits^{ + 4} \)
b) \(\mathop N\limits^{ - 3} \to \mathop N\limits^0 + 3e\); \(\mathop N\limits^0 \to \mathop N\limits^{ + 2} + 2e\); \(\mathop N\limits^{ + 2} \to \mathop N\limits^{ + 4} + 2e\); \(\mathop N\limits^{ + 4} \to \mathop N\limits^{ + 5} + 1e\); \(\mathop N\limits^{ + 5} + 3e \to \mathop N\limits^{ + 2} \)
12.13
Phản ứng nào sau đây là phản ứng oxi hoá – khử? Giải thích.
a) SO3 + H2O -> H2SO4
b) CaCO3 + 2HCl -> CaCl2 + CO2 + H2O
c) C + H2O -> CO + H2
d) CO2 + Ca(OH)2 -> CaCO3 + H2O
e) Ca + 2H2O -> Ca(OH)2 + H2
g) 2KMnO4 -> K2MnO4 + MnO2 + O2

Dựa vào định nghĩa phản ứng oxi hóa - khử: là phản ứng hóa học, trong đó có sự chuyển dịch electron giữa các chất, phản ứng hay có sự thay đổi số oxi hóa của một số nguyên tử trong phân tử.

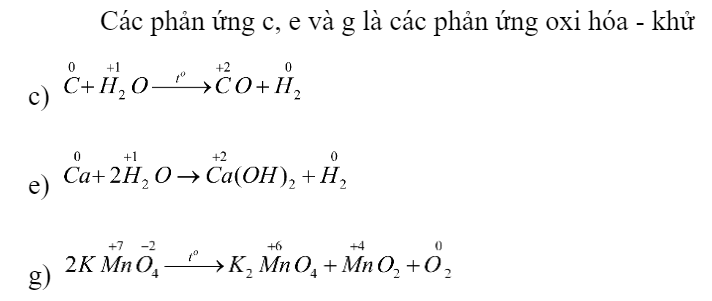
12.14
Gỉ sét là quá trình oxi hoá kim loại, mỗi năm phá huỷ khoảng 25% sắt thép. Gỉ sét được hình thành do kim loại sắt (Fe) trong gang hay thép kết hợp với oxygen khi có mặt nước hoặc không khí ầm. Trên bề mặt gang hay thép bị gỉ hình thành những lớp xốp và giòn dễ vỡ, thường có màu nâu, nâu đỏ hoặc đỏ. Lớp gỉ này không có tác dụng bảo vệ sắt ở phía trong. Sau thời gian dài, bất kì khối sắt nào cũng sẽ bị gỉ hoàn toàn và phân huỷ. Thành phần chính của sắt gỉ gồm Fe(OH)2, Fe2O3.nH2O.
Một số phản ứng xảy ra trong quá trình gỉ sắt:
Fe + O2 + H2O -> Fe(OH)2 (1)
Fe + O2 + H2O + CO2 -> Fe(HCO3)2 (2)
Fe(HCO3)2 -> Fe(OH)2 + CO2 (3)
Fe(OH)2 + O2 + H2O -> Fe2O3.nH2O (4)
a) Phản ứng nào ở trên là phản ứng oxi hoá – khử?
b) Xác định sự thay đổi số oxi hoá của các nguyên tố, nêu rõ chất oxi hoá, chất khử.
c) Cân bằng phản ứng trên bằng phương pháp thăng bằng electron.

- Định nghĩa phản ứng oxi hóa - khử: là phản ứng hóa học, trong đó có sự chuyển dịch electron giữa các chất, phản ứng hay có sự thay đổi số oxi hóa của một số nguyên tử trong phân tử.
- Các quy tắc xác định số oxi hóa
+ Quy tắc 1: Số oxi hóa của nguyên tử trong các đơn chất bằng 0
+ Quy tắc 2: Trong một phân tử, tổng số oxi hóa của các nguyên tử bằng 0
+ Quy tắc 3: Trong các ion, số oxi hóa của nguyên tử (đối với ion đơn nguyên tử) hay tổng số oxi hóa các nguyên tử (đối với ion đa nguyên tử) bằng điện tích của ion đó
+ Quy tắc 4
- Các bước cân bằng phản ứng oxi hóa - khử
+ Bước 1: Xác định số oxi hóa của các nguyên tử có sự thay đổi số oxi hóa trong phản ứng
=> Xác định chất oxi hóa, chất khử
Advertisements (Quảng cáo)
+ Bước 2: Viết quá trình oxi hóa và quá trình khử
+ Bước 3: Xác định (và nhân) hệ số thích hợp vào các quá trình sao cho tổng số electron chất khử nhường bằng tổng số electron chất oxi hóa nhận
+ Bước 4: Đặt các hệ số vào sơ đồ phản ứng. Cân bằng số lượng nguyên tử của các nguyên tố còn lại

a + b) Các phản ứng 1, 2, 4 là phản ứng oxi hóa - khử
\(\mathop {Fe}\limits^0 + \mathop {{O_2}}\limits^0 + {H_2}O \to \mathop {Fe}\limits^{ + 2} {(\mathop O\limits^{ - 2} H)_2}\) (1)
=> Fe là chất khử, O2 là chất oxi hóa
\(\mathop {Fe}\limits^0 + \mathop {{O_2}}\limits^0 + {H_2}O + C{O_2} \to \mathop {Fe}\limits^{ + 2} {(HC\mathop {{O_3}}\limits^{ - 2} )_2}\) (2)
=> Fe là chất khử, O2 là chất oxi hóa
\(\mathop {Fe}\limits^{ + 2} {(OH)_2} + \mathop {{O_2}}\limits^0 + {H_2}O \to \mathop {F{e_2}}\limits^{ + 3} \mathop {{O_3}}\limits^{ - 2} .n{H_2}O\) (4)
=> Fe(OH)2 là chất khử, O2 là chất oxi hóa
c) *Phương trình Fe + O2 + H2O ” Fe(OH)2 (1)
- Bước 1: \(\mathop {Fe}\limits^0 + \mathop {{O_2}}\limits^0 + {H_2}O \to \mathop {Fe}\limits^{ + 2} {(\mathop O\limits^{ - 2} H)_2}\)
=> Fe là chất khử, O2 là chất oxi hóa
- Bước 2:
+ Quá trình oxi hóa: \(\mathop {Fe}\limits^0 \to \mathop {Fe}\limits^{ + 2} + 2e\)
+ Quá trình khử: \(\mathop {{O_2}}\limits^0 + 4e \to 2\mathop {{O_2}}\limits^{ - 2} \)
- Bước 3:
|
2x |
\(\mathop {Fe}\limits^0 \to \mathop {Fe}\limits^{ + 2} + 2e\) |
|
1x |
\(\mathop {{O_2}}\limits^0 + 4e \to 2\mathop {{O_2}}\limits^{ - 2} \) |
- Bước 4: 2Fe + O2 + 2H2O ” 2Fe(OH)2
*Phương trình Fe + O2 + H2O + CO2 ” Fe(HCO3)2 (2)
- Bước 1: \(\mathop {Fe}\limits^0 + \mathop {{O_2}}\limits^0 + {H_2}O + C{O_2} \to \mathop {Fe}\limits^{ + 2} {(HC\mathop {{O_3}}\limits^{ - 2} )_2}\)
=> Fe là chất khử, O2 là chất oxi hóa
- Bước 2:
+ Quá trình oxi hóa: \(\mathop {Fe}\limits^0 \to \mathop {Fe}\limits^{ + 2} + 2e\)
+ Quá trình khử: \(\mathop {{O_2}}\limits^0 + 4e \to 2\mathop {{O_2}}\limits^{ - 2} \)
- Bước 3:
|
2x |
\(\mathop {Fe}\limits^0 \to \mathop {Fe}\limits^{ + 2} + 2e\) |
|
1x |
\(\mathop {{O_2}}\limits^0 + 4e \to 2\mathop {{O_2}}\limits^{ - 2} \) |
- Bước 4: 2Fe + O2 + 2H2O + 4CO2 ” 2Fe(HCO3)2 (2)
*Phương trình Fe(OH)2 + O2 + H2O ” Fe2O3.nH2O (4)
- Bước 1: \(\mathop {Fe}\limits^{ + 2} {(OH)_2} + \mathop {{O_2}}\limits^0 + {H_2}O \to \mathop {F{e_2}}\limits^{ + 3} \mathop {{O_3}}\limits^{ - 2} .n{H_2}O\)
=> Fe(OH)2 là chất khử, O2 là chất oxi hóa
- Bước 2:
+ Quá trình oxi hóa: \(\mathop {Fe}\limits^{ + 2} \to \mathop {Fe}\limits^{ + 3} + 1e\)
+ Quá trình khử: \(\mathop {{O_2}}\limits^0 + 4e \to 2\mathop {{O_2}}\limits^{ - 2} \)
- Bước 3:
|
4x |
\(\mathop {Fe}\limits^{ + 2} \to \mathop {Fe}\limits^{ + 3} + 1e\) |
|
1x |
\(\mathop {{O_2}}\limits^0 + 4e \to 2\mathop {{O_2}}\limits^{ - 2} \) |
- Bước 4: 4Fe(OH)2 + O2 + (2n-4)H2O -> 2Fe2O3.nH2O (4)
12.15
Rượu gạo là một thức uống có cồn lên men được chưng cất từ gạo theo truyền thống. Rượu gạo được làm từ quá trình lên men tinh bột gạo đã được chuyển thành đường. Vi khuẩn là nguồn gốc của các enzyme chuyển đổi tinh bột thành đường. Nhiệt độ phù hợp để lên men rượu khoảng 20 - 25°C.
Phản ứng thuỷ phân và phản ứng lên men.
(1) (C6H10O5)n + nH2O -> nC6H12O6
(2) C6H12O6 -> 2C2H5OH + 2CO2
a) Phản ứng nào ở trên là phản ứng oxi hoá – khử? Giải thích.
b) Trong phản ứng oxi hoá – khử, em hãy xác định số oxi hoá của các nguyên tố, nêu rõ chất oxi hoá, chất khử.
c) Cân bằng phản ứng oxi hoá – khử trên bằng phương pháp thăng bằng electron.

- Định nghĩa phản ứng oxi hóa - khử: là phản ứng hóa học, trong đó có sự chuyển dịch electron giữa các chất, phản ứng hay có sự thay đổi số oxi hóa của một số nguyên tử trong phân tử.
- Các quy tắc xác định số oxi hóa
+ Quy tắc 1: Số oxi hóa của nguyên tử trong các đơn chất bằng 0
+ Quy tắc 2: Trong một phân tử, tổng số oxi hóa của các nguyên tử bằng 0
+ Quy tắc 3: Trong các ion, số oxi hóa của nguyên tử (đối với ion đơn nguyên tử) hay tổng số oxi hóa các nguyên tử (đối với ion đa nguyên tử) bằng điện tích của ion đó
+ Quy tắc 4
- Các bước cân bằng phản ứng oxi hóa - khử
+ Bước 1: Xác định số oxi hóa của các nguyên tử có sự thay đổi số oxi hóa trong phản ứng
=> Xác định chất oxi hóa, chất khử
+ Bước 2: Viết quá trình oxi hóa và quá trình khử
+ Bước 3: Xác định (và nhân) hệ số thích hợp vào các quá trình sao cho tổng số electron chất khử nhường bằng tổng số electron chất oxi hóa nhận
+ Bước 4: Đặt các hệ số vào sơ đồ phản ứng. Cân bằng số lượng nguyên tử của các nguyên tố còn lại


12.16
Cân bằng phản ứng sau bằng phương pháp thăng bằng electron, nêu rõ chất oxi hoá, chất khử trong mỗi trường hợp sau:
a) H2S + SO2 -> S + H2O
b) SO2 + H2O + Cl2 -> H2SO4 + HCl
c) FeS2 + O2 -> Fe2O3 + SO2
d) C12H22O11 + H2SO4 -> CO2 + SO2 + H2O

+ Bước 1: Xác định số oxi hóa của các nguyên tử có sự thay đổi số oxi hóa trong phản ứng
=> Xác định chất oxi hóa, chất khử
+ Bước 2: Viết quá trình oxi hóa và quá trình khử
+ Bước 3: Xác định (và nhân) hệ số thích hợp vào các quá trình sao cho tổng số electron chất khử nhường bằng tổng số electron chất oxi hóa nhận
+ Bước 4: Đặt các hệ số vào sơ đồ phản ứng. Cân bằng số lượng nguyên tử của các nguyên tố còn lại

a) - Bước 1: \({H_2}\mathop S\limits^{ - 2} + \mathop S\limits^{ + 4} {O_2} \to \mathop S\limits^0 + {H_2}O\)
=> H2S là chất khử, SO2 là chất oxi hóa
- Bước 2:
+ Quá trình oxi hóa: \(\mathop S\limits^{ - 2} \to \mathop S\limits^0 + 2e\)
+ Quá trình khử: \(\mathop S\limits^{ + 4} + 4e \to \mathop S\limits^0 \)
- Bước 3:
|
2x |
\(\mathop S\limits^{ - 2} \to \mathop S\limits^0 + 2e\) |
|
1x |
\(\mathop S\limits^{ + 4} + 4e \to \mathop S\limits^0 \) |
- Bước 4: \(2{H_2}\mathop S\limits^{ - 2} + \mathop S\limits^{ + 4} {O_2} \to 3\mathop S\limits^0 + 2{H_2}O\)
b) - Bước 1: \(\mathop S\limits^{ + 4} {O_2} + {\rm{ }}{H_2}O{\rm{ }} + {\rm{ }}\mathop {C{l_2}}\limits^0 \to {H_2}\mathop S\limits^{ + 6} {O_4} + {\rm{ }}H\mathop {Cl}\limits^{ - 1} \)
=> SO2 là chất khử, Cl2 là chất oxi hóa
- Bước 2:
+ Quá trình oxi hóa: \(\mathop S\limits^{ + 4} \to \mathop S\limits^{ + 6} + 2e\)
+ Quá trình khử: \(\mathop {C{l_2}}\limits^0 + 2.1e \to 2\mathop {Cl}\limits^{ - 1} \)
- Bước 3:
|
1x |
\(\mathop S\limits^{ + 4} \to \mathop S\limits^{ + 6} + 2e\) |
|
1x |
\(\mathop {C{l_2}}\limits^0 + 2.1e \to 2\mathop {Cl}\limits^{ - 1} \) |
- Bước 4: \(\mathop S\limits^{ + 4} {O_2} + {\rm{ 2}}{H_2}O{\rm{ }} + {\rm{ }}\mathop {C{l_2}}\limits^0 \to {H_2}\mathop S\limits^{ + 6} {O_4} + {\rm{ 2}}H\mathop {Cl}\limits^{ - 1} \)
c) - Bước 1: \(\mathop {Fe}\limits^{ + 2} \mathop {{S_2}}\limits^{ - 1} + {\rm{ }}\mathop {{O_2}}\limits^0 \to \mathop {F{e_2}}\limits^{ + 3} {O_3} + {\rm{ }}\mathop S\limits^{ + 4} \mathop {{O_2}}\limits^{ - 2} \)
=> FeS2 là chất khử, O2 là chất oxi hóa
- Bước 2:
+ Quá trình oxi hóa: \(2(\mathop {Fe}\limits^{} \mathop {{S_2}}\limits^{} \mathop )\limits^0 \to 2\mathop {Fe}\limits^{ + 3} + 4\mathop S\limits^{ + 4} + 22e\)
+ Quá trình khử: \(\mathop {{O_2}}\limits^0 + 4e \to 2\mathop {{O_2}}\limits^{ - 2} \)
- Bước 3:
|
2x |
\(2(\mathop {Fe}\limits^{} \mathop {{S_2}}\limits^{} \mathop )\limits^0 \to 2\mathop {Fe}\limits^{ + 3} + 4\mathop S\limits^{ + 4} + 22e\) |
|
11x |
\(\mathop {{O_2}}\limits^0 + 4e \to 2\mathop {{O_2}}\limits^{ - 2} \) |
- Bước 4: \(4\mathop {Fe}\limits^{ + 2} \mathop {{S_2}}\limits^{ - 1} + {\rm{ 11}}\mathop {{O_2}}\limits^0 \to 2\mathop {F{e_2}}\limits^{ + 3} {O_3} + {\rm{ 8}}\mathop S\limits^{ + 4} \mathop {{O_2}}\limits^{ - 2} \)
d) - Bước 1: \(\mathop {{C_{12}}}\limits^0 {H_{22}}{O_{11}} + {\rm{ }}{H_2}\mathop S\limits^{ + 6} {O_4} \to \mathop C\limits^{ + 4} {O_2} + {\rm{ }}\mathop S\limits^{ + 4} {O_2} + {\rm{ }}{H_2}O\)
=> C12H22O11 là chất khử, H2SO4 là chất oxi hóa
- Bước 2:
+ Quá trình oxi hóa: \(\mathop {{C_{12}}}\limits^0 \to 12\mathop C\limits^{ + 4} + 12.4e\)
+ Quá trình khử: \(\mathop S\limits^{ + 6} + 2e \to \mathop S\limits^{ + 4} \)
- Bước 3:
|
1x |
\(\mathop {{C_{12}}}\limits^0 \to 12\mathop C\limits^{ + 4} + 12.4e\) |
|
24x |
\(\mathop S\limits^{ + 6} + 2e \to \mathop S\limits^{ + 4} \) |
- Bước 4: \(\mathop {{C_{12}}}\limits^0 {H_{22}}{O_{11}} + {\rm{ 24}}{H_2}\mathop S\limits^{ + 6} {O_4} \to 12\mathop C\limits^{ + 4} {O_2} + {\rm{ 24}}\mathop S\limits^{ + 4} {O_2} + {\rm{ 35}}{H_2}O\)
12.17
Cho potassium iodide (KI) tác dụng với potassium permanganate (KMnO4) trong dung dịch sulfuric acid (H2SO4), thu được 3,02 g manganese(II) sulfate (MnSO4), I2 và K2SO4.
a) Tính số gam iodine (I2) tạo thành.
b) Tính khối lượng potassium iodide (KI) đã tham gia phản ứng.

+ Bước 1: Xác định số oxi hóa của các nguyên tử có sự thay đổi số oxi hóa trong phản ứng
=> Xác định chất oxi hóa, chất khử
+ Bước 2: Viết quá trình oxi hóa và quá trình khử
+ Bước 3: Xác định (và nhân) hệ số thích hợp vào các quá trình sao cho tổng số electron chất khử nhường bằng tổng số electron chất oxi hóa nhận
+ Bước 4: Đặt các hệ số vào sơ đồ phản ứng. Cân bằng số lượng nguyên tử của các nguyên tố còn lại

a) - \({n_{MnS{O_4}}}\) = \(\frac{{3,02}}{{151}}\) = 0,02 mol
- Bước 1: \(K\mathop I\limits^{ - 1} {\rm{ }} + {\rm{ }}K\mathop {Mn}\limits^{ + 7} {O_4} + {\rm{ }}{H_2}S{O_4} \to \mathop {{I_2}}\limits^0 + {\rm{ }}\mathop {Mn}\limits^{ + 2} S{O_4} + {\rm{ }}{K_2}S{O_4} + {\rm{ }}{H_2}O\)
=> KI là chất khử, KMnO4 là chất oxi hóa
- Bước 2:
+ Quá trình oxi hóa: \(2\mathop I\limits^{ - 1} \to \mathop {{I_2}}\limits^0 + 2.1e\)
+ Quá trình khử: \(\mathop {Mn}\limits^{ + 7} + 5e \to \mathop {Mn}\limits^{ + 2} \)
- Bước 3:
|
5x |
\(2\mathop I\limits^{ - 1} \to \mathop {{I_2}}\limits^0 + 2.1e\) |
|
2x |
\(\mathop {Mn}\limits^{ + 7} + 5e \to \mathop {Mn}\limits^{ + 2} \) |
- Bước 4: \(10KI{\rm{ }} + {\rm{ }}2KMn{O_4} + {\rm{ }}8{H_2}S{O_4} \to 5{I_2} + {\rm{ }}2MnS{O_4} + {\rm{ }}6{K_2}S{O_4} + {\rm{ }}8{H_2}O\)
- Ta có phương trình:
10KI + 2KMnO4 + 8H2SO4 -> 5I2 + 2MnSO4 + 6K2SO4 + 8H2O
0,1 ! 0,05 ! 0,02 (mol)
=> Khối lượng iodine tạo thành là: 0,05.354 = 12,7 gam
b) Khối lượng potassium iodide (KI) đã tham gia phản ứng là: 0,1.156 = 15,6 gam
12.18
Hoà tan 14 g Fe trong dung dịch H2SO4 loãng, dư, thu được dung dịch X. Thêm dung dịch KMnO4 1 M vào dung dịch X. Biết KMnO4 có thể oxi hoá FeSO4 trong môi trường H2SO4 thành Fe2(SO4)3 và bị khử thành MnSO4. Phản ứng xảy ra hoàn toàn. Lập phương trình hoá học cho phản ứng oxi hoá - khử trên. Tính thể tích dung dịch KMnO4 1 M đã phản ứng.

- Viết phương trình oxi hóa - khử
- Tính số mol của các chất từ đó tính thể tích dung dịch KMnO4 1 M đã phản ứng

a) - \({n_{MnS{O_4}}}\) = \(\frac{{14}}{{56}}\) = 0,25 mol
- Bước 1: \(\mathop {Fe}\limits^{ + 2} S{O_4} + {\rm{ }}K\mathop {Mn}\limits^{ + 7} {O_4} + {\rm{ }}{H_2}S{O_4} \to \mathop {F{e_2}}\limits^{ + 3} {\left( {S{O_4}} \right)_3} + {\rm{ }}\mathop {Mn}\limits^{ + 2} S{O_4} + {\rm{ }}{K_2}S{O_4} + {\rm{ }}{H_2}O\)
=> FeSO4 là chất khử, KMnO4 là chất oxi hóa
- Bước 2:
+ Quá trình oxi hóa: \(2\mathop {Fe}\limits^{ + 2} \to \mathop {2Fe}\limits^{ + 3} + 2.1e\)
+ Quá trình khử: \(\mathop {Mn}\limits^{ + 7} + 5e \to \mathop {Mn}\limits^{ + 2} \)
- Bước 3:
|
5x |
\(2\mathop {Fe}\limits^{ + 2} \to \mathop {2Fe}\limits^{ + 3} + 2.1e\) |
|
2x |
\(\mathop {Mn}\limits^{ + 7} + 5e \to \mathop {Mn}\limits^{ + 2} \) |
- Bước 4: \(10FeS{O_4} + {\rm{ }}2KMn{O_4} + {\rm{ }}8{H_2}S{O_4} \to 5F{e_2}{\left( {S{O_4}} \right)_3} + {\rm{ }}2MnS{O_4} + {\rm{ }}{K_2}S{O_4} + {\rm{ }}8{H_2}O\)
- Ta có phương trình:
Fe + H2SO4 -> FeSO4 + H2
0,25 -> 0,25
10FeSO4 + 2KMnO4 + 8H2SO4 -> 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O
0,25 -> 0,05 (mol)
=> Thể tích dung dịch KMnO4 1 M đã phản ứng là: V = \(\frac{n}{{{C_M}}}\) = \(\frac{{0,05}}{1}\) = 0,05 (lít)
12.19
Nitric acid (HNO3) là hợp chất vô cơ, trong tự nhiên, được hình thành trong những con mưa giông kèm sấm chớp. Nitric acid là một acid độc, ăn mòn và dễ gây chảy là một trong những tác nhân gây ra mưa acid.
Thực hiện thí nghiệm xác định công thức của một oxide của kim loại sắt bằng nitric acid đặc nóng, thu được 2,479 lít (đkc) khí màu nâu là nitrogen dioxide. Phần dung dịch đem cô cạn thì được 72,6 g Fe(NO3)3. Giả sử phản ứng không tạo thành các sản phẩm khác (biết 1 mol khí chiếm 24,79 lít đo ở đkc 25°C, 1 bar).
a) Viết phản ứng và cân bằng bằng phương pháp thăng bằng electron.
b) Xác định công thức của iron oxide.

- Viết phương trình oxi hóa - khử
- Tính số mol của các chất từ đó tính thể tích dung dịch KMnO4 1 M đã phản ứng

a) - Đặt công thức hóa học của iron oxide là FexOy
- \({n_{N{O_2}}}\) = \(\frac{{2,479}}{{24,79}}\) = 0,1 mol; \({n_{Fe{{(N{O_3})}_3}}}\) = \(\frac{{72,6}}{{242}}\) = 0,3 mol
- Bước 1: \(F{e_x}{O_y} + {\rm{ }}H\mathop N\limits^{ + 5} {O_3} \to Fe{\left( {N{O_3}} \right)_3} + {\rm{ }}\mathop N\limits^{ + 4} {O_2} + {\rm{ }}{H_2}O\)
=> FexOy là chất khử, HNO3 là chất oxi hóa
- Bước 2:
+ Quá trình oxi hóa: \((\mathop {F{e_x}}\limits^{} \mathop {{O_y}}\limits^{} \mathop )\limits^0 \to x\mathop {Fe}\limits^{ + 3} + y\mathop O\limits^{ - 2} + (3x - 2y)e\)
+ Quá trình khử: \(\mathop N\limits^{ + 5} + 1e \to \mathop N\limits^{ + 4} \)
- Bước 3:
|
1x |
\((\mathop {F{e_x}}\limits^{} \mathop {{O_y}}\limits^{} \mathop )\limits^0 \to x\mathop {Fe}\limits^{ + 3} + y\mathop O\limits^{ - 2} + (3x - 2y)e\) |
|
(3x-2y)x |
\(\mathop N\limits^{ + 5} + 1e \to \mathop N\limits^{ + 4} \) |
- Bước 4: \(F{e_x}{O_y} + {\rm{ }}\left( {6x - 2y} \right)HN{O_3} \to xFe{\left( {N{O_3}} \right)_3} + {\rm{ }}\left( {3x - 2y} \right)N{O_2} + {\rm{ }}\left( {3x - y} \right){H_2}O\)
- Ta có phương trình:
FexOy + (6x-2y)HNO3 -> xFe(NO3)3 + (3x-2y)NO2 + (3x-y)H2O
\(\frac{{0,1x}}{{3x - 2y}}\)
=> \(\frac{{0,1x}}{{3x - 2y}}\) = 0,3 => \(\frac{x}{y}\) = \(\frac{3}{4}\)
=> Công thức của iron oxide là Fe3O4
Câu 20
Có nhiều vụ tai nạn giao thông xảy ra do người lái xe uống rượu. Theo luật định, hàm lượng ethanol trong máu người lái xe không vượt quá 0,02% theo khối lượng. Để xác định hàm lượng ethanol trong máu của người lái xe cần chuẩn độ ethanol bằng K2Cr2O7 trong môi trường acid. Khi đó Cr+6 bị khử thành Cr+3, ethanol (C2H5OH) bị oxi hoá thành acetaldehyde (CH3CHO).
a) Hãy viết phương trình hoá học của phản ứng.
b) Khi chuẩn độ 25 g huyết tương máu của một lái xe cần dùng 20 mL dung dịch K2Cr2O7 0,01M. Người lái xe đó có vi phạm luật hay không? Tại sao? Giả sử rằng trong thí nghiệm trên chỉ có ethanol tác dụng với K2Cr2O7.

- Viết phương trình oxi hóa - khử
- Tính số mol của các chất từ đó tính nồng độ % C2H5OH trong 25 g huyết tương máu

a) - Bước 1: \(\mathop {{C_2}}\limits^{ - 2} {H_5}OH{\rm{ }} + {\rm{ }}{K_2}\mathop {C{r_2}}\limits^{ + 6} {O_7} + {\rm{ }}{H_2}S{O_4} \to \mathop {{C_2}}\limits^{ - 1} {H_4}O{\rm{ }} + {\rm{ }}\mathop {C{r_2}}\limits^{ + 3} {\left( {S{O_4}} \right)_3} + {\rm{ }}{K_2}S{O_4} + {\rm{ }}{H_2}O\)
=> C2H5OH là chất khử, K2Cr2O7 là chất oxi hóa
- Bước 2:
+ Quá trình oxi hóa: \(2\mathop C\limits^{ - 2} \to 2\mathop C\limits^{ - 1} + 2.1e\)
+ Quá trình khử: \(2\mathop {Cr}\limits^{ + 6} + 2.3e \to 2\mathop {Cr}\limits^{ + 3} \)
- Bước 3:
|
3x |
\(2\mathop C\limits^{ - 2} \to 2\mathop C\limits^{ - 1} + 2.1e\) |
|
1x |
\(2\mathop {Cr}\limits^{ + 6} + 2.3e \to 2\mathop {Cr}\limits^{ + 3} \) |
- Bước 4: \(3{C_2}{H_5}OH{\rm{ }} + {\rm{ }}{K_2}C{r_2}{O_7} + {\rm{ }}4{H_2}S{O_4} \to 3{C_2}{H_4}O{\rm{ }} + {\rm{ }}C{r_2}{\left( {S{O_4}} \right)_3} + {\rm{ }}{K_2}S{O_4} + {\rm{ }}7{H_2}O\)
b) - \({n_{{K_2}C{r_2}{O_7}}}\) = 0,01.0,02 = 0,0002 mol
- Ta có phương trình:
3C2H5OH + K2Cr2O7 + 4H2SO4 -> 3C2H4O + Cr2(SO4)3 + K2SO4 + 7H2O
0,0006
=> C% (C2H5OH) = \(\frac{{0,0006×46}}{{25}}.100\% \) = 0,11% > 0,02%
=> Người lái xe đã vi phạm luật
