Câu hỏi/bài tập:
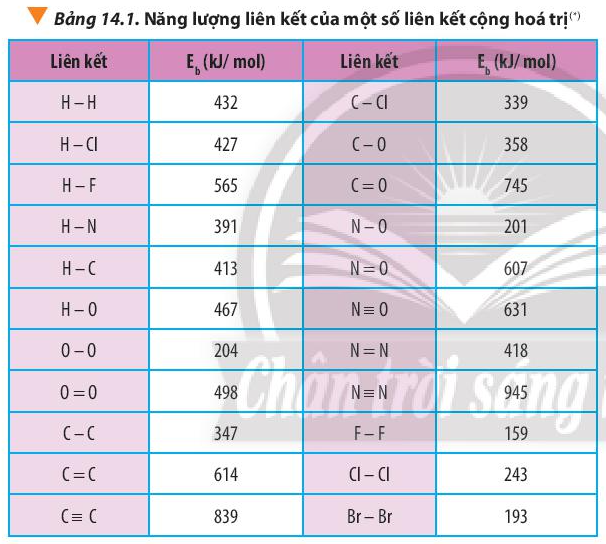
Tính nhiệt tạo thành chuẩn của HF và NO dựa vào năng lượng liên kết (Bảng 14.1 SGK), của F2, H2, HF, N2, O2, NO. Giải thích sự khác nhau về nhiệt tạo thành của HF và NO.

Dựa vào công thức \({\Delta _r}H_{298}^0 = \sum {{E_b}(cd)} - \sum {{E_b}(sp)} \) và bảng số liệu

- Biến thiên enthalpy của phản ứng H2(g) + F2(g) -> 2HF(g) là:
\({\Delta _r}H_{298}^0 = \sum {{E_b}(cd)} - \sum {{E_b}(sp)} \)
Advertisements (Quảng cáo)
=> \({\Delta _r}H_{298}^0 = {E_b}(H - H) + {E_b}(F - F) - 2.{E_b}(H - F)\)
=> \({\Delta _r}H_{298}^0 = 432 + 159 - 2.565 = - 539kJ\) < 0
=> Phản ứng xảy ra
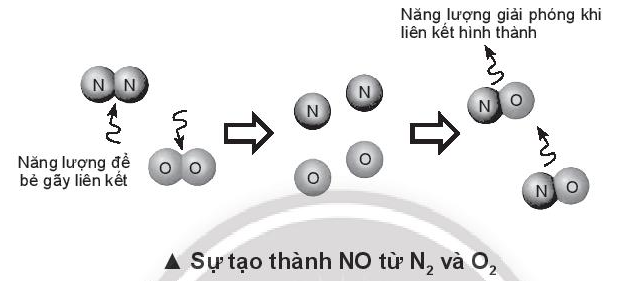
- Biến thiên enthalpy của phản ứng N2(g) + O2(g) ” 2NO(g) là:
\({\Delta _r}H_{298}^0 = \sum {{E_b}(cd)} - \sum {{E_b}(sp)} \)
=> \({\Delta _r}H_{298}^0 = {E_b}(N \equiv N) + {E_b}(O = O) - 2.{E_b}(N \equiv O)\)
=> \({\Delta _r}H_{298}^0 = 945 + 498 - 2.631 = + 181kJ\) > 0
=> Phản ứng không xảy ra
- Giải thích: Do năng lượng liên kết giữa liên kết ba của 2 nguyên tử Nitrogen rất lớn nên cần cung cấp năng lượng từ bên ngoài để phá vỡ liên kết N≡N
