Câu hỏi/bài tập:
Kim loại nhôm có thể khử được oxide của nhiều nguyên tố. Dựa vào nhiệt tạo thành chuẩn của các chất (Bảng 13.1 SGK), tính biến thiên enthalpy của phản ứng nhôm khử 1 mol mỗi oxide sau
a) Fe3O4(s)
b) Cr2O3(s)

Dựa vào công thức tính: \({\Delta _r}H_{298}^0 = \sum {{\Delta _r}H_{298}^0(sp)} - \sum {{\Delta _r}H_{298}^0(cd)} \) và bảng số liệu
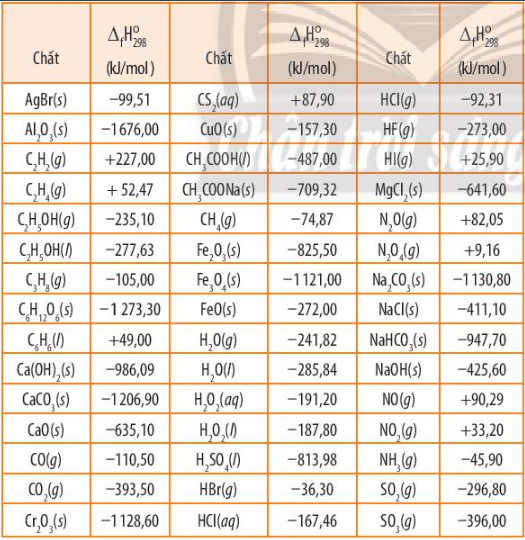

- Biến thiên enthalpy của phản ứng 8Al(s) + 3Fe3O4(s) 9Fe(s) + 4Al2O3(s) là:
\({\Delta _r}H_{298}^0 = \sum {{\Delta _r}H_{298}^0(sp)} - \sum {{\Delta _r}H_{298}^0(cd)} \)
Advertisements (Quảng cáo)
=> \({\Delta _r}H_{298}^0 = 4.{\Delta _r}H_{298}^0(A{l_2}{O_3}) - 3.{\Delta _r}H_{298}^0(F{e_3}{O_4})\) (Do \({\Delta _r}H_{298}^0\) của đơn chất = 0)
=> \({\Delta _r}H_{298}^0 = 4.( - 1676,00) - 3.( - 1121,00) = - 3341kJ\)
=> Biến thiên enthalpy của phản ứng nhôm khử 1 mol Fe3O4 là
\({\Delta _r}H_{298}^0 = \frac{1}{3}.( - 3341) = - 1113,67kJ\)
- Biến thiên enthalpy của phản ứng 2Al(s) + Cr2O3(s) 2Cr(s) + Al2O3(s) là:
\({\Delta _r}H_{298}^0 = \sum {{\Delta _r}H_{298}^0(sp)} - \sum {{\Delta _r}H_{298}^0(cd)} \)
=> \({\Delta _r}H_{298}^0 = {\Delta _r}H_{298}^0(A{l_2}{O_3}) - {\Delta _r}H_{298}^0(C{r_2}{O_3})\) (Do \({\Delta _r}H_{298}^0\) của đơn chất = 0)
=> \({\Delta _r}H_{298}^0 = ( - 1676,00) - ( - 1128,60) = - 547,4kJ\)
=> Biến thiên enthalpy của phản ứng nhôm khử 1 mol Cr2O3 là \({\Delta _r}H_{298}^0 = - 547,4kJ\)
