Câu hỏi/bài tập:
Oxide cao nhất của nguyên tố R thuộc nhóm VIA có 60% oxygen về khối lượng, là một sản phẩm trung gian để sản xuất acid H2SO4 có tầm quan trọng bậc nhất trong công nghiệp. Hãy xác định nguyên tố R và viết công thức oxide cao nhất của nguyên tố R.

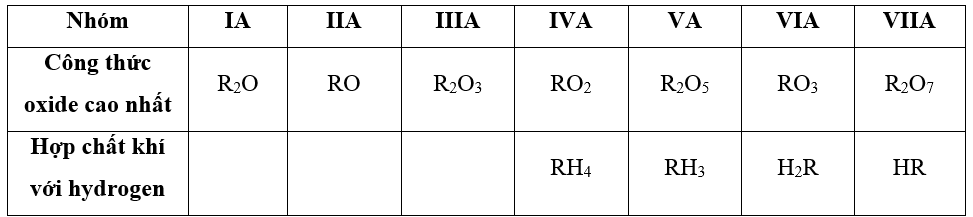
- Công thức oxide cao nhất và hợp chất khí với hydrogen của các nguyên tố từ IA đến VIIA
- Công thức thành phần phần trăm khối lượng của một nguyên tố trong hợp chất XaYb:
\(\% {m_X} = \frac{{a.{A_X}}}{{{A_{{X_a}{Y_b}}}}}.100\% = \frac{{a.{A_X}}}{{a.{A_X} + b.{A_Y}}}.100\% \)
Advertisements (Quảng cáo)
Trong đó: + AX là nguyên tử khối của nguyên tố X
+ AY là nguyên tử khối của nguyên tố Y

- R thuộc nhóm VIA => Công thức oxide cao nhất của R là RO3
- Có \(\% {m_O} = \frac{{3.{A_O}}}{{1.{A_R} + 3.{A_O}}}.100\% = \frac{{3.16}}{{1.{A_R} + 3.16}}.100\% = 60\% \) => AR = 32
- R có AR = 32 => R là nguyên tố Sulfur (S) => Công thức oxide cao nhất của S là SO3
