Câu hỏi/bài tập:
Oxide cao nhất của nguyên tố R có dạng R2O5, được sử dụng làm chất hút ẩm cho chất lỏng và khí. Hợp chất của R với hydrogen ở thể khí có chứa 8,82% hydrogen về khối lượng, là khí rất độc, gây chết với các triệu chứng khó hô hấp, đau đầu, chóng mặt, buồn nôn. Xác định công thức phân tử của hợp chất khí của R với hydrogen.

- Công thức oxide cao nhất và hợp chất khí với hydrogen của các nguyên tố từ IA đến VIIA
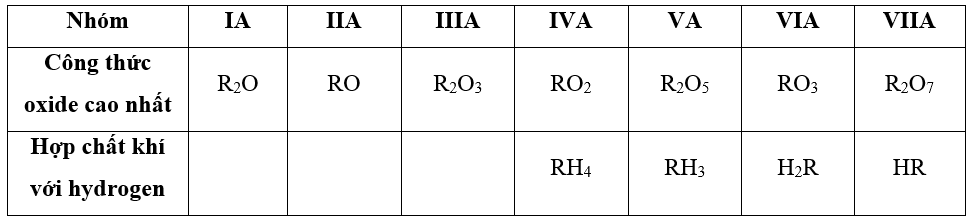
=> Xác định nhóm của nguyên tố
- Công thức thành phần phần trăm khối lượng của một nguyên tố trong hợp chất XaYb:
Advertisements (Quảng cáo)
\(\% {m_X} = \frac{{a.{A_X}}}{{{A_{{X_a}{Y_b}}}}}.100\% = \frac{{a.{A_X}}}{{a.{A_X} + b.{A_Y}}}.100\% \)
Trong đó: + AX là nguyên tử khối của nguyên tố X
+ AY là nguyên tử khối của nguyên tố Y

- Oxide cao nhất của nguyên tố R có dạng R2O5 => R thuộc nhóm VA => Công thức hợp chất khí của R với hydrogen là RH3
- Có \(\% {m_H} = \frac{{3.{A_H}}}{{1.{A_R} + 3.{A_H}}}.100\% = \frac{{3.1}}{{1.{A_R} + 3.1}}.100\% = 8,82\% \) => AR = 31
- R có AR = 31 => R là nguyên tố Phosphorus (P) => Hợp chất của Phosphorus với hydrogen là PH3
