Tính khối lượng phân amophot thu được khi cho khí \(N{H_3}\)tác dụng vừa đủ với 1,96 tấn axit photphpric khan tỉ lệ \({n_{N{H_3}}}:{n_{{H_3}P{O_4}}} = 3:2.\)
Tính thể tích không khí, nước cần thiết để sản xuất được khối lượng \(N{H_3}\) đã tham gia phản ứng trên. Biết rằng hiệu suất của quá trình sản xuất \(N{H_3}\) từ nước và không khí là 80%.

Số mol \({H_3}P{O_4}\) là 20000 mol
\(\eqalign{ & 2N{H_3} + \,\,\,\,\,\,\,\,\,\,\,2{H_3}P{O_4} \to \,\,\,\,\,\,\,\,\,\,\,\,N{H_4}{H_2}P{O_4} + {(N{H_4})_2}HP{O_4} \cr & 30000\,mol\,\,\,\, \leftarrow 20000\,mol \to 10000\,mol\,\,\,\,\,\,\,\,\,\,\,\,\,10000mol \cr} \)
Khối lượng amophot thu được : (115+132).10000 = 2470000 (g) = 2,47 tấn.
Theo phương trình điều chế \(N{H_3}\), ta có :
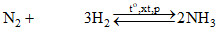
Advertisements (Quảng cáo)
Theo phương trình điều chế \({H_2}\) :
\(\eqalign{ & 2{H_2}O\buildrel {điện\,phân} \over \longrightarrow 2{H_2} + {O_2} \cr & 45000\,mol\, \leftarrow 45000\,mol \cr} \)
Vậy lượng nước cần thiết điều chế 30000 mol \(N{H_3}\) là :
\(45000.18{{100} \over {80}} = 1012500\,(ml) = 1012,5\,(l)\)
Nitơ chiếm 78% thể tích không khí
Vậy thể tích không khí cần thiết ở đktc là
\(15000.{{100} \over {78}}.{{100} \over {80}}.22,4 = 538461\,(l)\)
