Bài 7.19 trang 69 SBT Hóa Học 10 Nâng cao
Tính nồng độ cân bằng của các chất tham gia và tạo thành ở phản ứng:
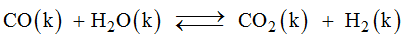
Nếu lúc đầu chỉ có CO và hơi nước với nồng độ [CO] = 0,1 mol/l, [H2O] = 0,4 mol/l, và hằng số cân bằng của phản ứng ở nhiệt độ đã cho là 1.

Advertisements (Quảng cáo)
Đặt nồng độ cân bằng của CO2 là x mol/l thì nồng độ cân bằng của H2 là x mol/l, của CO là mol/l và của H2O là mol/l.
\(\eqalign{
& K = {{\left[ {C{O_2}} \right].\left[ {{H_2}} \right]} \over {\left[ {CO} \right].\left[ {{H_2}O} \right]}} \cr&\;\;\;\;\,= {{{x^2}} \over {\left( {0,1 - x} \right)\left( {0,4 - x} \right)}} = 1 \cr
& \Rightarrow x = 0,08 \cr} \)
Vậy nồng độ cân bằng của CO2 là 0,08 mol/l; của H2 là 0,08 mol/l; của CO là 0,02 mol/l và của H2O là 0,32 mol/l.
