Đimetylamin \({(C{H_3})_2}NH + {H_2}O \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over {\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \) \({(C{H_3})_2}NH_2^ + + O{H^ - }\)
1. Viết biểu thức tính hằng số phân li bazơ \({K_b}\) của đimetylamin.
2. Tính pH của dung dịch đimetylamin 1,5M biết rằng \({K_b} = 5,{9.10^{ - 4}}\)

\(1.\,{K_b} = {{\left[ {{{(C{H_3})}_2}NH_2^ + } \right].\left[ {O{H^ - }} \right]} \over {\left[ {{{(C{H_3})}_2}NH} \right]}}\)
2. Trong 1 lít dung dịch có 1,5 mol \({(C{H_3})_2}NH\). Giả sử x mol chất này có phản ứng với nước :
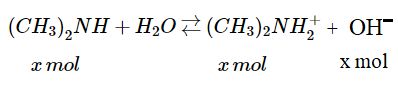
Vì \({K_b} = 5,{9.10^{ - 4}}\) lớn hơn rất nhiều so với tích số ion của nước \(({1.10^{ - 4}})\) nên có thể bỏ qua phần \(O{H^ - }\) sinh ra do sự điện li của nước.
Advertisements (Quảng cáo)
Khi cân bằng, \(\left[ {{{(C{H_3})}_2}NH_2^ + } \right] = \left[ {O{H^ - }} \right] = x\)
Nồng độ đimetylamin \(\left[ {{{\left( {C{H_3}} \right)}_2}NH} \right] = (1,5 - x)\)
Vì \({K_b}\) nhỏ nên 1,5-x coi như bằng 1,5
\({K_b} = {{{x^2}} \over {1,5}} = 5,{9.10^{ - 4}};\)\(x = \sqrt {1,5.5,{{9.10}^{ - 4}}} \approx 3,{0.10^{ - 2}}(mol).\)
Nồng độ \(O{H^ - }\) là \(3,{0.10^{ - 2}}\) do đó nồng độ \( {H^ + }\) là
\(\left[ {{H^ + }} \right] = {{1,{{0.10}^{ - 14}}} \over {3,{{0.10}^{ - 2}}}} \approx 3,{3.10^{ - 13}}(mol/l)\)
pH của dung dịch điêmtylamin 1,5M là \(pH = - \lg \left[ {{H^ + }} \right] = 12,48\) .
