Trộn 250 ml dung dịch hỗn hợp HCl 0,08 mol/l và \({H_2}S{O_4}\) 0,01 mol/l với 250 ml dung dịch \(Ba{(OH)_2}\) có nồng độ x mol/l thu được m gam kết tủa và 500 ml dung dịch có pH=12. Hãy tính m và x. Coi \(Ba{(OH)_2}\) điện li hoàn toàn cả hai nấc.

Số mol HCl ban đầu :\({{0,08.250} \over {1000}} = 0,02(mol)\)
Số mol \({H_2}S{O_4}\) ban đầu : \({{0,01.250} \over {1000}} = 0,0025(mol)\)
Sau phản ứng có dung dịch pH=12 nghĩa \(Ba{(OH)_2}\) còn dư và các axit đã phản ứng hết.
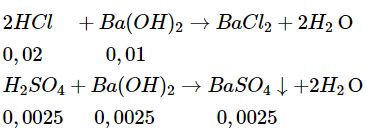
Khối lượng kết tủa : m = 0,0025.233 = 0,5825(g).
Sau phản ứng, dung dịch có pH=12 nghĩa là:
\(\left[ {{H^ + }} \right] = {10^{ - 12}}\left( {mol/l} \right)\)
Advertisements (Quảng cáo)
\( \to \left[ {O{H^ - }} \right] = {10^{ - 2}}\left( {mol/l} \right) = 0,01\) \(\left( {mol/l} \right)\)
Số mol \(OH^-\) trong dung dịch:
\({{0,01.500} \over {1000}} = 0,005\left( {mol} \right)\)
\(Ba{\left( {OH} \right)_2} \to B{a^{2 + }} + 2O{H^ - }\)
Số mol \(Ba(OH)_2\) còn dư \(= {1 \over 2}{n_{O{H^ - }}} = 0,0025\left( {mol} \right)\)
Số mol \(Ba(OH)_2\) ban đầu là: \(0,01+0,0025+0,0025 =0.015\) (mol)
Nồng độ \(Ba(OH)_2\) là: \(x = {{0,015} \over {0,25}} = 0,06\) (mol/l)
