Điện phân dung dịch \(CuC{l_2}\) với các điện cực bằng graphit.
a) Hãy dự đoán hiện tượng xảy ra ở các điện cực. Trình bày sơ đồ điện phân và viết phương trình hoá học của sự điện phân
b) Sau một thời gian, người ta ngừng điện phân và tách toàn bộ lượng kim loại vừa điện phân được ra khỏi điện cực, làm khô, cân được
0,544 g.
Hãy tính:
- Số mol kim loại thu được.
- Thể tích khí thu được ở đktc.
c) Biết thời gian điện phân kéo dài 16 phút với cường độ dòng điện không đổi. Tính cường độ dòng điện đã dùng.
Đáp án
a) Cực âm có kim loại Cu bám bên ngoài: \(C{u^{2 + }} + 2e \to Cu.\)
Cực dương có khí \(C{l_2}\) thoát ra: \(2C{l^ - } \to C{l_2} + 2e.\)
Sơ đồ điện phân:
Advertisements (Quảng cáo)
Cực âm \( \leftarrow \) dung dịch \(CuC{l_2} \to \) Cực dương
\(C{u^{2 + }},{H_2}O\) \(C{l^ - },{H_2}O\)
\(C{u^{2 + }} + 2e \to Cu\) \(2C{l^ - } \to C{l_2} + 2e\)
Phương trình hoá học của sự điện phân:
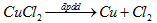
b) Lượng kim loại Cu thu được ở cực âm:
\({n_{Cu}} = {{0,544} \over {64}} = 0,0085\left( {mol} \right)\)
Theo phương trình điện phân: \({n_{C{l_2}}} = {n_{Cu}} = 0,0085mol\)
\( \Rightarrow {V_{C{l_2}}} = 0,0085.22,4 = 0,1904\) (lít).
c) Cường độ dòng điện
\(I = {{0,544.96500.2} \over {64.16.60}} = 1,709\left( A \right).\)
