Có những cặp oxi hoá - khử sau:
\(A{g^ + }/Ag\); \(F{e^{2 + }}/Fe\);
\(Z{n^{2 + }}/Zn\); \(H{g^{2 + }}/Hg\).
a) Viết phương trình hoá học của phản ứng biến đổi giữa chất oxi hoá và chất khử trong mỗi cặp.
b) Các cặp oxi hoá - khử trên được sắp xếp thành dãy điện hoá:
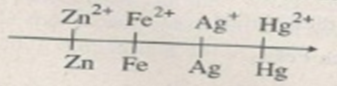
Hãy cho biết:
1) Chất oxi hoá mạnh nhất;
2) Chất oxi hoá yếu nhất;
3) Chất khử mạnh nhất;
4) Chất khử yếu nhất.
c) Những ion kim loại nào có thể oxi hoá được:
1) Zn; 2) Fe; 3) Ag?
d) Viết các phương trình hoá học của phản ứng xảy ra trong câu c.
e) Tra cứu tài liệu để cho biết điện thế cực chuẩn của mỗi cặp oxi hoá - khử đã cho ở trên.
Đáp án
Advertisements (Quảng cáo)
b) 1) Chất oxi hoá mạnh nhất: \(H{g^{2 + }}\);
2) Chất oxi hoá yếu nhất: \(Z{n^{2 + }};\)
3) Chất khử mạnh nhất: Zn;
4) Chất oxi hoá yếu nhất: Hg.
c) 1) Ion kim loại có thể oxi hoá Zn là: \(F{e^{2 + }},A{g^ + },H{g^{2 + }}.\)
2) Ion kim loại có thể oxi hoá Fe là: \(A{g^ + },H{g^{2 + }}.\)
3) Ion kim loại có thể oxi hoá Ag là: \(H{g^{2 + }}.\)
d) 1) Những phản ứng oxi hoá Zn
\(\eqalign{ & F{e^{2 + }} + Zn \to Fe + Z{n^{2 + }} \cr & 2A{g^ + } + Zn \to 2Ag + Z{n^{2 + }} \cr & H{g^{2 + }} + Zn \to Z{n^{2 + }} + Hg \cr} \)
2) Những phản ứng oxi hoá Fe:
\(\eqalign{ & 2A{g^ + } + Fe \to 2Ag + F{e^{2 + }} \cr & H{g^{2 + }} + Fe \to F{e^{2 + }} + Hg \cr} \)
3) Phản ứng oxi hoá Ag
\(H{g^{2 + }} + 2Ag \to 2A{g^ + } + Hg\)
e) Thế điện cực chuẩn của các cặp oxi hoá-khử:
\(E_{Z{n^{2 + }}/Zn}^o = - 0,76V;\) \(E_{F{e^{2 + }}/Fe}^o = - 0,44V;\)
\(E_{A{g^ + }/Ag}^o = + 0,80V;\) \(E_{H{g^{2 + }}/Hg}^o = + 0,85V;\)
