Điện phân dung dịch \(AgN{O_3}\) với các điện cực trơ là graphit.
a) Trình bày sơ đồ điện phân dung dịch \(AgN{O_3}\) và viết phương trình hoá học của sự điện phân.
b) Thời gian điện phân là 14 phút 15 giây, cường độ dòng điện không đổi là 0,8A. Tính khối lượng bạc điều chế được.
c) Tính thể tích khí (đktc) thu được ở anot.
Đáp án
a) Sơ đồ điện phân dung dịch \(AgN{O_3}\), điện cực graphit
Cực âm \( \leftarrow \)dung dịch \(AgN{O_3}\)\( \to \) Cực dương
\(A{g^ + },{H_2}O\) \(NO_3^ - ,{H_2}O\)
Advertisements (Quảng cáo)
\(A{g^ + } + e \to Ag\) \(2{H_2}O \to 4{H^ + } + {O_2} + 4e\)
Phương trình hoá học của sự điện phân: 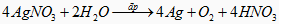
Sau khi hết \(AgN{O_3},{H_2}O\) bị điện phân.
b) Khối lượng Ag điều chế được
\({m_{Ag}} = {{108.0,8.855} \over {96500.1}} = 0,765\left( g \right)\)
c) Thể tích khí (đktc) thu được ở anot:
\({n_{{O_2}}} = {1 \over 4}{n_{Ag}} = {{0.765} \over {108.4}} = 0,00177\left( {mol} \right)\)
\({V_{{O_2}}} = 22,4.0,00177 = 0,0396\) (lít) = 39,6 ml
