Điện phân dung dịch \(CuS{O_4}\) với các điện cực trơ bằng graphit.
a) Viết các phản ứng xảy ra ở các điện cực.
b) Điện phân dung dịch trên với thời gian 1 giờ, cường độ dòng điện cố định là 0,16 A. Tính khối lượng Cu điều chế được.
c) Dung dịch \(CuS{O_4}\) trước khi điện phân có thể tích là 100 ml, nồng độ 0,5 M. Tính số mol các ion có trong dung dịch trước khi điện phân.
d) Tính nồng độ mol của các ion có trong dung dịch sau điện phân. Coi thể tích của dung dịch sau điện phân thay đổi không đáng kể.
Đáp án
a) Các phản ứng xảy ra ở các điện cực:
Ở catot xảy ra sự khử các ion \(C{u^{2 + }}:C{u^{2 + }} + 2e \to Cu\)
Ở anot xảy ra sự oxi hoá các phân tử nước: \(2{H_2}O \to 4{H^ + } + {O_2} + 4e\)
b) Khối lượng Cu điều chế được: \({m_{Cu}} = {{64.0,16.3600} \over {96500.2}} = 0,19(g)\)
Advertisements (Quảng cáo)
c) Số mol các ion có trong dung dịch trước khi điện phân:
Trong 100 ml dung dịch có 0,05 mol \(CuS{O_4}\), ta có:
\({n_{C{u^{2 + }}}} = {n_{SO_4^{2 - }}} = {n_{CuS{O_4}}} = 0,05(mol)\)
d) Nồng độ mol của các ion sau điện phân:
Phương trình hoá học điện phân dung dịch \(CuS{O_4}\):
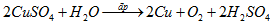
Ta có:
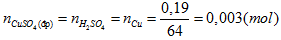
Số mol \(CuS{O_4}\), dư sau điện phân : 0,05-0,003=0,047 (mol)
Từ những kết quả trên, ta tính được nồng độ mol của các ion trong dung dịch điện phân: \(\eqalign{ & {C_{M({H^ + })}} = {{1000.0,006} \over {100}} = 0,06(M) \cr & {C_{M(C{u^{2 + }})}} = {{1000.0,047} \over {100}} = 0,47(M) \cr & {C_{M(SO_4^{2 - })}} = {{1000(0,047 + 0,003)} \over {100}} = 0,5(M) \cr} \)
