b) Tính nồng độ mol các chất có trong dung dịch sau điện phân. Cho rằng thể tích của dung dịch sau điện phân thay đổi không đáng kể.. Câu 5.56 trang 43 Sách bài tập (SBT) Hóa Nâng cao - Bài 24. Điều chế kim loại
Điện phân 200 ml dung dịch \(AgN{O_3}\) 0,4M vớiđiện cực trơ trong thời gian 4 giờ, cường độ dòng điện là 0,402A.
a) Tính khối lượng Ag thu được sau điện phân.
b) Tính nồng độ mol các chất có trong dung dịch sau điện phân. Cho rằng thể tích của dung dịch sau điện phân thay đổi không đáng kể.
Đáp án
a) Khối lượng Ag thu được sau điện phân:
\({m_{Ag}} = {{108.0,402.4.60.60} \over {96500.1}} = 6,48\left( g \right)\), ứng với \({n_{Ag}} = {{6,48} \over {108}} = 0,06\left( {mol} \right)\)
b) Nồng độ mol các chất sau điện phân:
\( \bullet \) Lượng \(AgN{O_3}\) có trong dung dịch trước điện phân:
Advertisements (Quảng cáo)
\({n_{AgN{O_3}}} = {{0,4.200} \over {1000}} = 0,08\left( {mol} \right)\)
\( \bullet \) Phương trình hoá học của sự điện phân:
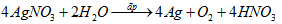
Ta có: \({n_{AgN{O_3}}} = {n_{Ag}} = {n_{HN{O_3}}} = 0,06mol\)
Số mol \(AgN{O_3}\) còn dư sau điện phân:
\({n_{AgN{O_3}}} = 0,08 - 0,06 = 0,02\left( {mol} \right)\)
\( \bullet \) Nồng độ mol các chất trong dung dịch sau điện phân:
\(\eqalign{ & {C_{M\left( {AgN{O_3}} \right)}} = {{1000.0,02} \over {200}} = 0,1\left( M \right) \cr & {C_{M\left( {HN{O_3}} \right)}} = {{1000.0,06} \over {200}} = 0,3\left( M \right) \cr} \)
