Từ anđehit no, đơn chức A có thể chuyển trực tiếp thành ancol B và axit D tương ứng để điều chế este E từ B và D
1. Viết phương trình hóa học của pahnr ứng và tính tỉ số \({{{M_E}} \over {{M_A}}}({M_E},{M_A}\) là khối lượng mol phân tử của E và A).
2. Nếu đun nóng m g E và KOH thì cho \({m_1}\) g muối kali, còn với dung dịch \(Ca{(OH)_2}\) sẽ cho \({m_2}\) g muối canxi. Biết \({m_2} < m < {m_1}\)
Hãy xác định công thức cấu tạo A, B, D, E
3. Nung \({m_1}\) g muối kali ở trên với hỗn hợp vôi tôi và KOH thì cho 2,24 lít khí G ở đktc. Tính \({m_1},{m_2},m\)

1. Gọi công thức của anđehit A là RCHO \((R = {C_n}{H_{2n + 1}})\), \({M_R}\) là khối lượng của gốc \({C_n}{H_{2n + 1}}\)
\(\eqalign{
& RCHO + {1 \over 2}{O_2}\buildrel {M{n^{2 + }}} \over
\longrightarrow RCOOH \cr
& RCHO + {H_2}\buildrel {Ni,{t^o}} \over
\longrightarrow R - C{H_2} - OH \cr} \)
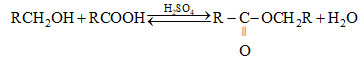
\({{{M_E}} \over {{M_A}}} = {{2{M_R} + 58} \over {{M_R} + 29}} = 2\)
\(2.\;RCOOC{H_2}R + KOH\buildrel {{t^0}} \over
\longrightarrow\) \( RCOOK + RC{H_2}OH\)
\({m_1} = {{m({M_R} + 83)} \over {2{M_R} + 29}}\)
có
\(\eqalign{ & m < {{m({M_R} + 83)} \over {2{M_R} + 58}} \to {M_R} < 25 \cr} \)
Advertisements (Quảng cáo)
\(2RCOOC{H_2}R + Ca{(OH)_2} \to\)\( {(RCOO)_2}Ca + 2RC{H_2}OH\)
\({m_2} = {{m(2{M_R} + 128)} \over {4{M_R} + 116}}\)
có
\(\eqalign{ & m > {{m(2{M_R} + 128)} \over {4{M_R} + 116}} \to {M_R} > 6 \cr & 6 < {M_R} < 25 \Leftrightarrow 6 < 14n + 1 < 25 \cr & \to 0,35 < n < 1,7 \to n = 1, \cr} \) ,
R là \(C{H_3}\)
Vậy :
\(\eqalign{ & A:C{H_3}CHO;\,\,\,\,\,\,\,\,D.C{H_3}{\rm{COOH}} \cr & {\rm{B:}}{{\rm{C}}_2}{H_5}OH;\,\,\,\,\,\,\,\,\,\,\,\,\,E.C{H_3}{\rm{COO}}{{\rm{C}}_2}{H_5} \cr} \)
3. Nung muối \(C{H_3}{\rm{COO}}K\) với hỗn hợp vôi tôi và KOH
\(C{H_3}{\rm{COOK + KOH}}\buildrel {CaO,{t^o}} \over \longrightarrow \) \(C{H_4} + {K_2}C{O_3}\)
Khí G là \(C{H_4}\) có số mol là 0,10 mol. Vậy \({m_1} = 0,10.98 = 9,80(g)\)
Khối lượng E là : m= 0,10.88=8,80(g).
Số mol muối canxi = 0,05 mol, nên khối lượng \({m_2} = 0,05.158 = 7,90(g)\)
